题目内容
【化学一有机化学基础】(15分)直接生成碳-碳键的反应是实现高效、绿色有机合成的重要途径。交叉脱氢偶联反应是近年备受关注的一类直接生成碳-碳键的新反应。例如:

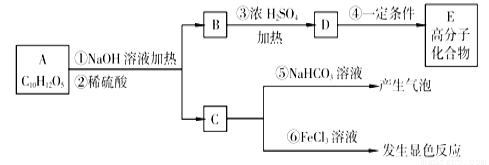
化合物Ⅰ可由以下合成路线获得:

(1)化合物Ⅰ的分子式为___________,其在NaOH溶液中水解的化学方程式为_____。
(2化合物Ⅱ与足量浓氢溴酸反应的化学方程式为_________________________________。
(3化合物Ⅲ没有酸性,其结构简式为___________________;Ⅲ的一种同分异构体Ⅴ能与饱和NaHCO3溶液反应放出CO2,化合物Ⅴ的结构简式为______________________________。
(4)反应①中1个脱氢剂Ⅵ(结构简式如 )分子获得2个氢原子后,转变成1个芳香族化合物分子,该芳香族化合物分子的结构简式为________________________。
)分子获得2个氢原子后,转变成1个芳香族化合物分子,该芳香族化合物分子的结构简式为________________________。
(5)1分子 与1分子
与1分子 在一定条件下可发生类似反应①的反应,其产物分子的结构简式为______________________;1mol该产物最多可与______molH2发生加成反应。
在一定条件下可发生类似反应①的反应,其产物分子的结构简式为______________________;1mol该产物最多可与______molH2发生加成反应。
(1)C5H8O4 (1分) H3COOCCH2COOCH3+2NaOH 2CH3OH+NaOOCCH2COONa(2分)(2)HOCH2CH2CH2OH+2HBr
2CH3OH+NaOOCCH2COONa(2分)(2)HOCH2CH2CH2OH+2HBr CH2BrCH2CH2Br+2H2O(2分)
CH2BrCH2CH2Br+2H2O(2分)
(3)OHCCH2CHO(2分) CH2=CHCOOH(2分)
(4) (2分)(5)
(2分)(5) (2分)8(2分)
(2分)8(2分)
【解析】
试题分析:(1)根据化合物的结构简式可知化合物Ⅰ的分子式为C5H8O4,分子中含有2个酯基,则其在NaOH溶液中水解的化学方程式为H3COOCCH2COOCH3+2NaOH 2CH3OH+NaOOCCH2COONa。
2CH3OH+NaOOCCH2COONa。
(2)Ⅳ与甲醇发生酯化反应生成I,则Ⅳ的结构简式为HOOCCH2COOH。Ⅲ发生银镜反应生成Ⅳ,则Ⅲ的结构简式为OHCCH2CHO,Ⅱ发生催化氧化生成Ⅲ,则Ⅲ的结构简式为HOCH2CH2CH2OH。醇与溴化氢发生取代反应的方程式为HOCH2CH2CH2OH+2HBr CH2BrCH2CH2Br+2H2O。
CH2BrCH2CH2Br+2H2O。
(3)根据以上分析可知Ⅲ的结构简式为HOCH2CH2CH2OH。Ⅲ的一种同分异构体Ⅴ能与饱和NaHCO3溶液反应放出CO2,说明分子中含有羧基,因此根据分子式可知一定还含有碳碳双键,则化合物Ⅴ的结构简式为CH2=CHCOOH。
(4) 分子获得2个氢原子后,转变成1个芳香族化合物分子,这说明分子中含有苯环,则碳氧双键均变为酚羟基,因此该芳香族化合物分子的结构简式为
分子获得2个氢原子后,转变成1个芳香族化合物分子,这说明分子中含有苯环,则碳氧双键均变为酚羟基,因此该芳香族化合物分子的结构简式为 。
。
(5)反应①属于取代反应形成碳碳单键,则1分子 与1分子
与1分子 在一定条件下发生类似反应①的反应,其产物分子的结构简式为
在一定条件下发生类似反应①的反应,其产物分子的结构简式为 。该化合物分子中含有2个苯环、1个碳碳三键,所以1mol该产物最多可与8molH2发生加成反应。
。该化合物分子中含有2个苯环、1个碳碳三键,所以1mol该产物最多可与8molH2发生加成反应。
考点:考查有机物推断、同分异构体判断以及方程式书写等

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案(14分)I.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)

(1)上图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式_________________________________________。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g) 2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请完成下列问题。
①试比较K1、K2的大小,K1___________K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是______________(填序号字母):
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,当测得NH3和N2、H2的物质的量分别为1mol和2mol、3mol时,则该反应的v(N2)正______________v(N2)逆(填写“>”、“=”或“<”)。
II.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)。
酸或碱 | 电离平衡常数(Ka或 Kb) |
CH3COOH | 1.8×10-5 |
HNO2 | 4.6×10-4 |
HCN | 5×10-10 |
HClO | 3×10-8 |
NH3·H2O | 1.8×10-5 |
请回答下列问题:
(1)上述四种酸中,酸性最弱的是_________________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是_________________(填序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈____(选填“酸性”“中性”或“碱性”),理由是:__________________________,溶液中各离子浓度大小的关系是__________________________________。
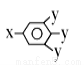 (其中-x、-y均为官能团)。请回答下列问题:
(其中-x、-y均为官能团)。请回答下列问题: 还原为Cr3+,并通过调节废水的pH,使生成物组成符合类似于铁氧体(Fe3O4或Fe2O3·FeO)的复合氧化物
还原为Cr3+,并通过调节废水的pH,使生成物组成符合类似于铁氧体(Fe3O4或Fe2O3·FeO)的复合氧化物 。处理含1 mol Cr2O
。处理含1 mol Cr2O 废水至少需要加入a mol FeSO4·7H2O。下列结论正确的是
废水至少需要加入a mol FeSO4·7H2O。下列结论正确的是


 键长小于
键长小于 键,所以C60熔沸点低于Si60
键,所以C60熔沸点低于Si60
