题目内容
13.若某原子在处于能量最低状态时,外围电子排布为4d15s2,则下列说法正确的是( )| A. | 该元素最高正化合价为+2 | B. | 该元素原子核外共有5个电子层 | ||
| C. | 该元素原子的M能层共有8个电子 | D. | 该元素原子最外层共有3个电子 |
分析 某原子在处于能量最低状态时,外围电子排布为4d15s2,应为Y元素,位于周期表第ⅢB族,该元素基态原子的电子排布式为1s22s22p63s23p63d104s24p64d15s2,以此解答该题.
解答 解:根据核外电子排布规律,该元素基态原子的电子排布式为1s22s22p63s23p63d104s24p64d15s2.由此可见:该元素原子中共有39个电子,分5个电子层,其中M能层上有18个电子,最外层上有2个电子.
A.外围电子排布为4d15s2,元素最高正化合价为+3,故A错误;
B.由外围电子排布为4d15s2,可知原子核外共有5个电子层,故B正确;
C.该元素原子M能层共有18个电子,M层电子排布为3s23p63d10,故C错误;
D.该元素原子最外层为5s2,有2个电子,故D错误.
故选B.
点评 本题考查原子核外电子排布,为高频考点,侧重于学生的分析能力的考查,题目难度不大,本题注意元素价层电子排布特点以及与在周期表位置的关系,该类题目易错,学习中注意体会.

练习册系列答案
相关题目
8.下列物质中,属于天然高分子化合物的是( )
| A. | 聚乙烯 | B. | 蔗糖 | C. | 淀粉 | D. | 麦芽糖 |
18.下列叙述正确的是( )
| A. | 将一定体积醋酸溶液加水到原来体积的m倍,则pH增大m | |
| B. | 在NaHCO3溶液中,c(Na+)=c(HCO3-)+c(H2CO3) | |
| C. | 25℃,pH=8的NaOH溶液和pH=8的氨水中,由水电离出的c(OH-)不相等 | |
| D. | 25℃,pH=13的Ba(OH)2溶液和pH=1的盐酸中均存在:c(H+)•c(OH-)=1×10-14 |
5.等物质的量的CH4、C2H4、C2H2,分别在足量的氧气中充分燃烧,以下说法正确的是( )
| A. | C2H2含碳量最高,燃烧生成的CO2最多 | |
| B. | C2H4燃烧生成水与CO2的物质的量相等 | |
| C. | CH4含氢量最高,燃烧生成水最多 | |
| D. | CH4、C2H4燃烧生成水的质量不相同,消耗氧气不同 |
2.某同学写出下列烷烃的名称中,不正确的是( )
| A. | 2,3-二甲基丁烷 | B. | 3,3-二甲基丁烷 | ||
| C. | 3-甲基-3-乙基戊烷 | D. | 2,2,3,3-四甲基丁烷 |
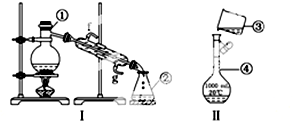
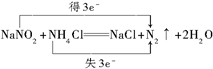 (并标出电子转移的数目和方向).
(并标出电子转移的数目和方向). 已知1-丙醇和2-丙醇的结构简式如下:
已知1-丙醇和2-丙醇的结构简式如下: .
. ,你判断的依据是因为其分子有三种不同化学环境的氢原子,所以应该有三个氢原子的吸收峰,并且符合1:1:6的峰面积比关系.
,你判断的依据是因为其分子有三种不同化学环境的氢原子,所以应该有三个氢原子的吸收峰,并且符合1:1:6的峰面积比关系.