题目内容
在一定固定体积的真空容器中充入1molPCl5,200℃时发生下列反应PCl5(g)?PCl3(g)+Cl2(g),达到平衡后,其他条件不变,再充入1molPCl5下列说法错误的是( )
| A、平衡向正向移动 |
| B、重新达到平衡时PCl5转化率增大 |
| C、重新达到平衡后PCl3体积分数减小 |
| D、反应速率加快 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:假设开始加入2molPCl5所到达的平衡,可以等效为先将体积增大1倍到达的平衡状态,该状态与开始加入1molPCl5是完全相同的平衡状态,然后在将体积压缩恢复到原来的体积,增大压强平衡向体积减小的方向移动,据此判断.
解答:
解:假设开始加入2molPCl5所到达的平衡,可以等效为先将体积增大1倍到达的平衡状态,该状态与开始加入1molPCl5是完全相同的平衡状态,然后在将体积压缩恢复到原来的体积,增大压强平衡向体积减小的方向移动,即平衡向逆反应方向移动,PCl5的分解率减小,
A、再充入反应物,反应物浓度增大,平衡正向移动,故A正确;
B、PCl5转化率减小,故B错误;
C、重新达到平衡后PCl3体积分数减小,故C正确;
D、压强增大,反应速率加快,故D正确;
故选B.
A、再充入反应物,反应物浓度增大,平衡正向移动,故A正确;
B、PCl5转化率减小,故B错误;
C、重新达到平衡后PCl3体积分数减小,故C正确;
D、压强增大,反应速率加快,故D正确;
故选B.
点评:本题考查等效平衡,难度中等,关键是设计平衡建立的途径,可以直接等效为增大压强.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别是( )
| A、1000mL,212g |
| B、950mL,543.4g |
| C、950mL,572g |
| D、500mL,286g |
在体积相同的A、B两个带活塞的玻璃容器中,分别注入
体积颜色相同的NO2与溴蒸气,然后将活塞同时向外拉出到
(快速),过一会可以看到( )
| 1 |
| 4 |
| 1 |
| 2 |
| A、A中的颜色比B中的浅 |
| B、A中的颜色比B中的深 |
| C、A中的颜色与B中的深浅相同 |
| D、A中颜色比开始时深 |
“活化分子”是衡量化学反应速率快慢的重要依据,下列有关说法不正确的是( )
| A、能够发生有效碰撞的分子一定是活化分子 |
| B、增大浓度,单位体积内活化分子数增加,化学反应速率增大 |
| C、加入反应物,使活化分子百分数增大,化学反应速率增大 |
| D、一般使用催化剂可以降低反应的活化能,增大活化分子百分数,增大化学反应速率 |
化学与生活密切相关.下列情况会对人体健康造成较大危害的是( )
| A、用Cl2对自来水进行消毒杀菌 |
| B、用SO2漂白食品 |
| C、用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) |
| D、用小苏打(NaHCO3)发酵面团制作馒头 |
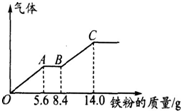 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )| A、H2SO4浓度为2.5 mol?L-1 |
| B、第二份溶液中最终溶质为FeSO4 |
| C、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 |
| D、原混合酸中NO3-物质的量为0.1mol |
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,工业上合成氨反应通常用铁触媒作催化剂,反应方程式为:N2+3H2?2NH3△H<0.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,工业上合成氨反应通常用铁触媒作催化剂,反应方程式为:N2+3H2?2NH3△H<0.