题目内容
 在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol?L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如右图所示,则下列说法中,不正确的是( )
在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol?L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如右图所示,则下列说法中,不正确的是( )| A、①点所示溶液的导电能力弱于②点 |
| B、图中点③所示溶液中,c(CH3COO-)<c(Na+) |
| C、图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度 |
| D、滴定过程中的某点,会有c(Na+)=c(CH3COO-)>c(H+)=c(OH-)的关系存在 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A、①点加入的NaOH的物质的量少,溶液中是大量的弱电解质CH3COOH和少量的CH3COONa;②点溶液呈中性,溶液中是极少量的CH3COOH和大量的CH3COONa;
B、根据③点溶液呈碱性并结合电荷守恒来分析;
C、①溶液中是大量的弱电解质CH3COOH和少量的CH3COONa;③点溶液中是CH3COONa;
D、当c(H+)=c(OH-)时,溶液呈中性,结合电荷守恒来分析;
B、根据③点溶液呈碱性并结合电荷守恒来分析;
C、①溶液中是大量的弱电解质CH3COOH和少量的CH3COONa;③点溶液中是CH3COONa;
D、当c(H+)=c(OH-)时,溶液呈中性,结合电荷守恒来分析;
解答:
解:A、①点加入的NaOH的物质的量少,溶液中是大量的弱电解质CH3COOH和少量的强电解质CH3COONa;②点溶液呈中性,溶液中是极少量的CH3COOH和大量的强电解质CH3COONa,故②点溶液中的离子浓度大于①,故导电能力①弱于②点,故A正确;
B、③点溶液呈碱性,故有:c(H+)<c(OH-),而根据溶液的电荷守恒可有:c(CH3COO-)<c(Na+),故B正确;
C、①溶液中是大量的弱电解质CH3COOH和少量的CH3COONa,CH3COOH的大量存在抑制水的电离;③点溶液中的溶质是CH3COONa,CH3COONa的水解促进水的电离,故图中点①所示溶液中水的电离程度小于点③所示溶液中水的电离程度,故C错误;
D、根据电荷守恒可知,当c(H+)=c(OH-)时,c(CH3COO-)=c(Na+),此时溶液呈中性,溶液中是极少量的CH3COOH和大量的强电解质CH3COONa,故有:c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故D正确.
故选C.
B、③点溶液呈碱性,故有:c(H+)<c(OH-),而根据溶液的电荷守恒可有:c(CH3COO-)<c(Na+),故B正确;
C、①溶液中是大量的弱电解质CH3COOH和少量的CH3COONa,CH3COOH的大量存在抑制水的电离;③点溶液中的溶质是CH3COONa,CH3COONa的水解促进水的电离,故图中点①所示溶液中水的电离程度小于点③所示溶液中水的电离程度,故C错误;
D、根据电荷守恒可知,当c(H+)=c(OH-)时,c(CH3COO-)=c(Na+),此时溶液呈中性,溶液中是极少量的CH3COOH和大量的强电解质CH3COONa,故有:c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故D正确.
故选C.
点评:本题考查酸碱混合溶液定性判断及溶液中离子浓度大小比较,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,注意电荷守恒、物料守恒、盐的水解等在比较离子浓度大小中的应用方法.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
煤的气化是工业生产中煤的综合利用的方法之一.已知下列热化学方程式:
①C(s)+O2(g)=CO2(g)△H1=-393.5kJ?mol-1
②H2(g)+
O2(g)=H2O(g)△H2=-242.0kJ?mol-1
③CO(g)+
O2(g)=CO2(g)△H3=-283.0kJ?mol-1
④C(s)+H2O(g)=CO(g)+H2(g)△H4,则△H4为( )
①C(s)+O2(g)=CO2(g)△H1=-393.5kJ?mol-1
②H2(g)+
| 1 |
| 2 |
③CO(g)+
| 1 |
| 2 |
④C(s)+H2O(g)=CO(g)+H2(g)△H4,则△H4为( )
| A、-131.5kJ?mol-1 |
| B、+352.5kJ?mol-1 |
| C、-352.5kJ?mol-1 |
| D、+131.5kJ?mol-1 |
下列说法不正确的是( )
| A、可以用Si3N4、Al2O3制作高温结构陶瓷制品 |
| B、雾霾天气首要污染物为PM2.5(指大气中直径小于或等于2.5微米的颗粒物),PM2.5在空气中一定形成气溶胶 |
| C、化学家鲍林提出了氢键理论和蛋白质分子的螺旋结构模型,为DNA分子双螺旋结构模型的提出奠定了基础 |
| D、据测定,许多反应的温度每升高10K,其反应速率增加2~4倍.在实验室或工业生产中,常采用加热的方法使化学反应在较高的温度下进行,以提高反应速率 |
下列各组物质只用胶头滴管和试管不能鉴别的是( )
| A、KOH溶液与AlCl3溶液 |
| B、MgCl2溶液与氨水 |
| C、NaAlO2溶液与盐酸 |
| D、Na2CO3溶液与盐酸 |
化学与生产和生活密切相关,下列说法正确的是( )
| A、14C可用于文物年代的鉴定,是12C的同素异形体 |
| B、向含重金属离子的工业废水中加入明矾,然后再将废水排放 |
| C、利用催化设施,可以将汽车尾气中CO和NO转化为无害气体 |
| D、配制氯化亚锡(SnCl2)溶液时需加适量盐酸目的是防止其被氧化变浑浊 |
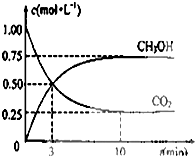 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇,一定条件下发生如下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇,一定条件下发生如下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 某探究活动小组想利用原电池反应检测金属的活动性顺序,有甲、乙两位同学均使用镁片与铝片作电极,但甲同学将电极放入6mol?L-1稀H2SO4中,乙同学将电极放入6mol?L-1的NaOH溶液中,如图所示.
某探究活动小组想利用原电池反应检测金属的活动性顺序,有甲、乙两位同学均使用镁片与铝片作电极,但甲同学将电极放入6mol?L-1稀H2SO4中,乙同学将电极放入6mol?L-1的NaOH溶液中,如图所示.
 是一种酯类物质,回答下列问题:
是一种酯类物质,回答下列问题: ,Ⅱ有两种同分异构体在一定条件下可相互反应生成
,Ⅱ有两种同分异构体在一定条件下可相互反应生成 ,这两种同分异构体的结构简式分别为
,这两种同分异构体的结构简式分别为