题目内容
16.对于合成氨反应N2(g)+3H2(g)?2NH3(g) 298K时,△H=-92.2kJ•mol-1,△S=-198.2kJ•mol-1•K-1,下列说法正确的是( )
| A. | 升高温度和增大压强都有利于平衡向生成氨的方向移动 | |
| B. | 298K时合成氨反应不能自发进行 | |
| C. | 298K时合成氨的反应速率一定很大 | |
| D. | 298K时合成氨反应可自发进行 |
分析 A、正反应是气体体积缩小的放热反应;
B、根据△G=△H-T△S,进行判断;
C、温度越高反应速率越快;
D、根据△G=△H-T△S,进行判断.
解答 解:A、正反应是气体体积缩小的放热反应,所以降低温度和增大压强都有利于平衡向生成氨的方向移动,故A错误;
B、因为△H=-92.2kJ•mol-1,△S=-198.2kJ•mol-1•K-1,由△G=△H-T△S=-92.2kJ•mol-1+198.2kJ•mol-1•K-1×298K>0,所以反应不能自发,故B正确;
C、温度越高反应速率越快,而298K时是低温,所以反应速率很低,故C错误;
D、因为△H=-92.2kJ•mol-1,△S=-198.2kJ•mol-1•K-1,由△G=△H-T△S=-92.2kJ•mol-1+198.2kJ•mol-1•K-1×298K>0,所以反应不能自发,故D错误;
故选B.
点评 本题考查了化学反应速率和反应自发进行的分析判断,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
6.下列说法中正确的是 ( )
| A. | 第一电离能由大到小的顺序为O>N>C | |
| B. | NO3-中N采用sp2杂化,故NO3-的空间构型为三角锥形 | |
| C. | 由于C22-和O22+为等电子体,所以可以判断O22+的电子式为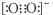 | |
| D. | 液态HF通常也可以写成(HF)n的形式,是因为液态HF分子间存在氢键 |
7.工业上以沙子为原料制取粗硅,主要反应的化学方程式为2C(s)+SiO2(s)=Si (s)+2CO(g)△H>O,对该反应的说法中不正确的是( )
| A. | △S>0 | |
| B. | 产物CO 为酸性氧化物 | |
| C. | 高温条件下才能自发进行 | |
| D. | 采用碎沙而非石块的原因可能是加快反应速率 |
4.有一学生欲配制下列无色透明溶液,其中可能实现的是( )
| A. | K+、Na+、MnO4-、SO42- | B. | Fe3+、Na+、HCO3-、Cl- | ||
| C. | K+、Cu2+、S2-、SO42- | D. | Na+、K+、OH-、AlO2- |
1.下列物质的保存方法正确的是( )
| A. | 少量白磷保存在冷水中 | B. | 氢氧化钠固体敞口放在空气中 | ||
| C. | 生石灰露置于空气中 | D. | 浓盐酸盛放在敞口玻璃瓶中 |
8.下列说法中正确的是( )
| A. | 羟基和氢氧根离子有相同的化学式和结构式 | |
| B. | 乙醇的官能团是羟基 | |
| C. | NaOH中含有羟基 | |
| D. | 乙醇与钠反应中,羟基被取代 |
6.“纳米材料”是指直径在几纳米到几十纳米的材料.如将“纳米材料”分散到液体分散剂中,所得混合物具有的性质是( )
| A. | 能全部透过半透膜 | B. | 所得物质一定为悬浊液或乳浊液 | ||
| C. | 所得混合物一定能导电 | D. | 有丁达尔效应 |