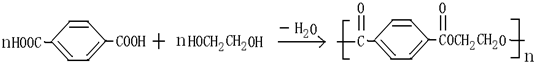题目内容
10.下列化学用语的相关表述正确的是( )| A. | H+(aq)+OH-(aq)=H2O(l)△H=-a kJ/mol,故1 mol NaOH固体与足量的稀盐酸反应,放出热量为akJ | |
| B. | 因CuSO4•5H2O(s)═CuSO4(s)+5H2O(1)△H=+b kJ/mol,故1 mol CuSO4(s)溶于足量水时,放出热量为bkJ | |
| C. | 因氢气的燃烧热为c kJ/mol,故电解水的热化学方程式为:2H2O(1)═2H2(g)+O2(g)△H=+c kJ/mol | |
| D. | 因N2(g)+3H2(g)?2NH3(g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于dkJ |
分析 A.根据NaOH固体溶于水要放热;
B.根据无水硫酸铜溶解为溶液时,先放热变成五水硫酸铜,五水硫酸铜再溶吸收热量,最终表现为放热,放出的热量是两次热量变化之差;
C.燃烧热是指1 mol物质完全燃烧生成稳定氧化物时所放出的热量,氢气燃烧反应是放热反应,逆向是吸热反应;
D.根据N2(g)+3H2(g)?2NH3为可逆反应,不能进行到底.
解答 解:A.NaOH固体溶于水要放热,故1 mol NaOH固体与足量的稀盐酸反应,放出的热量大于a kJ,故A错误;
B.CuSO4•5H2O(s)═CuSO4(s)+5H2O(l)△H=+b kJ/mol,故1 mol CuSO4(s)与水生成CuSO4•5H2O,放出bkJ热量,生成的CuSO4•5H2O溶于水时溶液吸热,所以1 mol CuSO4(s)溶于水时,放出的热量是两次热量变化之差,小于b kJ热量,故B错误;
C.燃烧热是指1 mol物质完全燃烧生成稳定氧化物时所放出的热量,氢气的燃烧热为c kJ/mol,故电解水的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+2c kJ/mol,故C错误;
D.根据N2(g)+3H2(g)?2NH3为可逆反应,不能进行到底,故向某容器中通人1 mol N2与3 mol H2充分反应后,放出的热量小于d kJ,故D正确;
故选D.
点评 本题考查了物质溶解过程中的能量变化、盖斯定律的运用以及可逆反应的特征,题目难度中等.

练习册系列答案
相关题目
20.元素周期律产生的根本原因就是随着元素原子序数的递增( )
| A. | 元素的相对原子质量逐渐增大 | B. | 核外电子排布呈周期性变化 | ||
| C. | 原子半径呈周期性变化 | D. | 元素主要化合价呈周期性变化 |
5.某溶液中只可能含有下列离子的几种:Na+、NH4+、Ba2+、SO42-、I-、CO32-为了确定该溶液中的离子种类,某学生已做了以下两个实验:①取样,用pH计测试,溶液显弱酸性;②另取样,加氯水和淀粉无明显现象.还需检验的离子是( )
| A. | Na+ | B. | SO42- | C. | Ba2+ | D. | NH4+ |
15.下列化学用语表达正确的是( )
| A. | N2的结构式: | |
| B. | 次氯酸的结构式为:H-Cl-O | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p6 | |
| D. | NH3的电子式: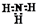 |