题目内容
已知反应:X+Y=M+N为放热反应,对该反应的下列说法中正确的是( )
| A、X的能量一定高于M |
| B、X和Y的总能量一定高于M和N的总能量 |
| C、Y的能量一定高于N |
| D、因为该反应为放热反应,故不必加热反应就可发生 |
考点:吸热反应和放热反应
专题:化学反应中的能量变化
分析:反应X+Y=M+N为放热反应,则反应物的总能量比生成物的总能量高,以此来解答.
解答:
解:A.反应物的总能量大于生成物的总能量,X的能量与Y的能量关系无法确定,故A错误;
B.该反应为放热反应,所以反应物的总能量大于生成物的总能量,即X和Y的总能量一定高于M和N的总能量,故B正确;
C.反应物的总能量大于生成物的总能量,Y的能量不一定高于N,故C错误;
D.反应的放热、吸热与反应条件(如加热)无关,某些放热反应也需要加热才能反应,如氢气和氧气的反应,故D错误.
故选B.
B.该反应为放热反应,所以反应物的总能量大于生成物的总能量,即X和Y的总能量一定高于M和N的总能量,故B正确;
C.反应物的总能量大于生成物的总能量,Y的能量不一定高于N,故C错误;
D.反应的放热、吸热与反应条件(如加热)无关,某些放热反应也需要加热才能反应,如氢气和氧气的反应,故D错误.
故选B.
点评:本题考查放热反应与反应物和生成物的总能量的关系,为高频考点,侧重于学生的分析能力的考查,注意信息中反应为放热反应来解答,难度不大.

练习册系列答案
相关题目
金属镍有广泛的用途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述中正确的是(已知氧化性:Fe2+<Ni2+<Cu2+)( )
| A、阳极发生还原反应,其电极反应式:Ni2++2e-═Ni |
| B、电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C、电解后,溶液中存在的离子只有Fe2+ 和Zn2+ |
| D、电解后,Cu和Pt沉降在电解槽底部形成阳极泥 |
元素周期表中ⅣA元素包括C、Si、Ce、Sn、Pb等,已知Sn的+4价稳定,而Pb的+2价稳定.结合所学知识,判断下列反应中(反应条件略)正确的是( )
①Pb+2Cl2=PbCl4
②Sn+2Cl2=SnCl4
③SnCl2+Cl2=SnCl4
④PbO2+4HCl=PbCl4+2H2O
⑤Pb3O4+8HCl=3PbCl2+Cl2↑+4H2O.
①Pb+2Cl2=PbCl4
②Sn+2Cl2=SnCl4
③SnCl2+Cl2=SnCl4
④PbO2+4HCl=PbCl4+2H2O
⑤Pb3O4+8HCl=3PbCl2+Cl2↑+4H2O.
| A、①②④⑤ | B、①②③④ |
| C、①②③ | D、②③⑤ |
下列说法中正确的是( )
| A、原电池放电过程中,负极质量一定减轻,或正极的质量一定增加 |
| B、Fe、Cu组成原电池:Fe一定是负极 |
| C、为加快一定量的Zn与足量稀H2SO4反应的速率,且不影响生成H2总量,可加入少量CuSO4 溶液 |
| D、某海水电池总反应表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,则负极反应式:Ag-e-+Cl-=AgCl |
下列变化过程中的能量变化与其它三个不相同的是( )
| A、生石灰与水混合 |
| B、天然气燃烧 |
| C、浓硫酸溶于水 |
| D、干冰气化 |
下列有关说法不正确的是( )
| A、C3H8中碳原子都采用的是sp3杂化 |
| B、O2、CO2、N2都是非极性分子 |
| C、酸性:H2CO3<H3PO4<H2SO4<HClO |
D、CO的一种等电子体为NO+,它的电子式为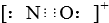 |
已知M2O7x-+3S 2-+14H+=2M3++3S↓+7H2O,则M2O7x-中的M的化合价为( )
| A、+2价 | B、+3价 |
| C、+4价 | D、+6价 |
在0.5L某浓度的Na2SO4溶液中含有0.5mol Na+,对该溶液的说法不正确的是( )
| A、该溶液的物质的量浓度为1 mol?L-1 |
| B、该溶液中含有35.5 g Na2SO4 |
| C、配制100 mL该溶液需用7.1 g Na2SO4 |
| D、量取100 mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1 mol |