题目内容
 实验室通常用如图所示的装置来制取氨气.回答下列问题:
实验室通常用如图所示的装置来制取氨气.回答下列问题:(1)制取氨气时的化学反应方程式为:
(2)收集氨气时必须使用干燥的集气装置的原因是
(3)加热后将蘸有浓盐酸的玻璃棒靠近导管口,产生的现象是:
分析:(1)实验室用氯化铵固体和氢氧化钙固体反应制备氨气,二者反应生成氨气、氯化钙、水;
(2)依据氨气极易溶于水的物理性质解答;
(3)氯化氢和氨气接触立即产生白烟.
(2)依据氨气极易溶于水的物理性质解答;
(3)氯化氢和氨气接触立即产生白烟.
解答:解:(1)氯化铵固体和氢氧化钙固体反应的方程式:Ca(OH)2+2NH4Cl
CaCl2+2H2O+2NH3↑;
故答案为:Ca(OH)2+2NH4Cl
CaCl2+2H2O+2NH3↑;
(2)氨气极易溶于水,如果集气装置中有水,则氨气溶于水,得不到气体,所以收集氨气必须用干燥的集气装置;
故答案为:因为氨气极易溶于水;
(3)氯化氢和氨气接触立即生成氯化铵固体,看到的现象是产生白烟,
故答案为:产生白烟.
| ||
故答案为:Ca(OH)2+2NH4Cl
| ||
(2)氨气极易溶于水,如果集气装置中有水,则氨气溶于水,得不到气体,所以收集氨气必须用干燥的集气装置;
故答案为:因为氨气极易溶于水;
(3)氯化氢和氨气接触立即生成氯化铵固体,看到的现象是产生白烟,
故答案为:产生白烟.
点评:本题考查了实验室氨气的制取,把握反应原理、实验现象、实验基本操作是解题关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
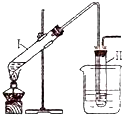 实验室用如图所示的装置制取溴乙烷.在试管Ⅰ中依次加入2mL蒸馏水、4mL浓硫酸、2mL95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管Ⅰ至微沸状态数分钟后,冷却.已知:通常情况下,溴乙烷呈液态,其密度比水大且不溶于水.试回答下列问题:
实验室用如图所示的装置制取溴乙烷.在试管Ⅰ中依次加入2mL蒸馏水、4mL浓硫酸、2mL95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管Ⅰ至微沸状态数分钟后,冷却.已知:通常情况下,溴乙烷呈液态,其密度比水大且不溶于水.试回答下列问题:(1)试管Ⅰ中硫酸和溴化钠加热反应生成氢溴酸.写出氢溴酸与乙醇在加热时反应的化学方程式
(2)在反应发生后试管II中可观察到的现象是
(3)溴乙烷为无色油状液体.若试管II中获得的有机物呈棕黄色,除去其中的杂质应选用的试剂是
A.CCl4 B.NaOH溶液 C.Na2SO3溶液
利用上述试剂充分洗涤后,分离混合物的操作是
(4)设计实验证明有机物溴乙烷中含有溴元素.完成以下实验报告:
| 实验步骤 | 实验操作 | 预期现象和结论 | ① | 取少量除杂后的溴乙烷于试管中, |
② | 取①中反应后的上层清液少量于另一支试管中, |
 实验室通常用如图所示的装置来制取氨气.回答下列问题:
实验室通常用如图所示的装置来制取氨气.回答下列问题: 实验室通常用如图所示的装置来制取氨气.回答下列问题:
实验室通常用如图所示的装置来制取氨气.回答下列问题: 实验室通常用如图所示的装置来制取氨气.回答下列问题:
实验室通常用如图所示的装置来制取氨气.回答下列问题: