题目内容
在由铜片、锌片和200mL一定浓度的稀硫酸组成的原电池中,请判断:
①现象: .
②铜片为 极,电极反应式为 ;锌片为 极:电极反应式为 .
①现象:
②铜片为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:Cu、Zn和稀硫酸构成的原电池中,Zn易失电子作负极、Cu作正极,负极上电极反应式为Zn-2e-=Zn2+,正极上电极反应式为2H++2e-=H2↑,据此分析解答.
解答:
解:Cu、Zn和稀硫酸构成的原电池中,Zn易失电子作负极、Cu作正极,负极上电极反应式为Zn-2e-=Zn2+,正极上电极反应式为2H++2e-=H2↑,
(1)所以看到的现象是:锌片逐渐溶解,铜片上有大量气泡产生,故答案为:锌片逐渐溶解,铜片上有大量气泡产生;
(2)Cu不易失电子作正极、锌易失电子作负极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,负极上电极反应式为Zn-2e-=Zn2+,故答案为:正;2H++2e-=H2↑;负极;Zn-2e-=Zn2+.
(1)所以看到的现象是:锌片逐渐溶解,铜片上有大量气泡产生,故答案为:锌片逐渐溶解,铜片上有大量气泡产生;
(2)Cu不易失电子作正极、锌易失电子作负极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,负极上电极反应式为Zn-2e-=Zn2+,故答案为:正;2H++2e-=H2↑;负极;Zn-2e-=Zn2+.
点评:本题考查了原电池原理,会根据实验现象确定正负极,知道其电极反应式的书写,题目难度不大.

练习册系列答案
相关题目
下列过程中,不涉及化学变化的是( )
| A、浓硫酸加入蔗糖固体中 |
| B、氨气溶于水,水溶液呈碱性 |
| C、SO2使品红溶液褪色 |
| D、四氯化碳萃取碘水中的碘 |
 为验证人体呼出气体中含有的CO2不是来自空气,而是人体代谢作用产生的.某学校学生课外活动小组设计了如图所示装置(备注:通过呼吸口慢吸慢呼来实现),你认为该装置应选用的试剂是( )
为验证人体呼出气体中含有的CO2不是来自空气,而是人体代谢作用产生的.某学校学生课外活动小组设计了如图所示装置(备注:通过呼吸口慢吸慢呼来实现),你认为该装置应选用的试剂是( )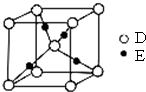 已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满.回答下列问题(用元素符号或化学式表示).
已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满.回答下列问题(用元素符号或化学式表示). 有如图实验装置,其中a、b、c为弹簧夹.
有如图实验装置,其中a、b、c为弹簧夹.