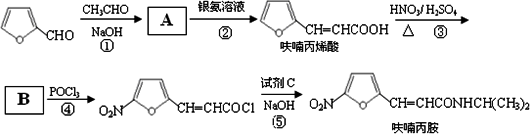
题目内容
 随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化的排放的控制力度.消除氮氧化物污染有多种方法,其中一种是用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)?N2(g)+CO2(g)△H>0.
随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化的排放的控制力度.消除氮氧化物污染有多种方法,其中一种是用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)?N2(g)+CO2(g)△H>0.某研究小组向某密闭容器充入一定量的活性炭和NO,每隔一定时间就对该容器内的物质分析,得到如下表数据:
| 时间/min | 0 | 20 | 40 | 50 |
| c(NO)/mol?L-1 | 0.100 | 0.040 | 0.032 | 0.032 |
| c(N2)/mol?L-1 | 0 | 0.030 | 0.034 | 0.034 |
(2)若其他条件不变,达到平衡后,下列措施能提高NO转化率的是
A.升高温度 B.增大压强 C.分离出N2 D.使用催化剂
(3)计算该温度下反应的平衡常数(写出计算过程,计算结果保留两位有效数字).
(4)其它条件相同时,在温度为T1和T2(T1>T2)时分别发生反应.T1时NO的转化率随时间的变化如图,请在图上画出T2时,NO的转化率随时间变化的示意图.
考点:化学平衡的计算,用化学平衡常数进行计算,化学平衡的影响因素,转化率随温度、压强的变化曲线
专题:
分析:(1)从反应开始直至20min时,NO的平均反应速率为V=
=
=0.003 mol?L-1?min-1;0~50min时间范围内,NO的平均反应速率逐渐减小,但不为零;
(2)A.升高温度,平衡向正反应方向移动,NO的转化率增大;B.反应前后,气体体积不变,增大压强,平衡不移动;C.分离出N2,平衡向正反应方向移动,NO的转化率增大; D.使用催化剂,平衡不移动;
(3)根据三段式进行计算;
(4)其它条件相同时,在温度为T1和T2(T1>T2)时分别发生反应,降温平衡向逆反应方向移动,T2时,NO的转化率降低,达到平衡所需时间增长.
| △c |
| △t |
| (0.1-0.04)mol/L |
| 20min |
(2)A.升高温度,平衡向正反应方向移动,NO的转化率增大;B.反应前后,气体体积不变,增大压强,平衡不移动;C.分离出N2,平衡向正反应方向移动,NO的转化率增大; D.使用催化剂,平衡不移动;
(3)根据三段式进行计算;
(4)其它条件相同时,在温度为T1和T2(T1>T2)时分别发生反应,降温平衡向逆反应方向移动,T2时,NO的转化率降低,达到平衡所需时间增长.
解答:
解:(1)从反应开始直至20min时,NO的平均反应速率为V=
=
=0.003 mol?L-1?min-1;0~50min时间范围内,NO的平均反应速率逐渐减小,但不为零;
故答案为:0.003 mol?L-1?min-1;逐渐减小,但不为零;
(2)A.升高温度,平衡向正反应方向移动,NO的转化率增大,故A正确;
B.反应前后,气体体积不变,增大压强,平衡不移动,故B错误;
C.分离出N2,平衡向正反应方向移动,NO的转化率增大,故C正确;
D.使用催化剂,平衡不移动,故D错误;
故答案为:AC;
(3)C(s)+2NO(g)?N2(g)+CO2(g)
起始浓度(mol/L):0.100 0 0
转化浓度(mol/L):0.068 0.034 0.034
平衡浓度(mol/L):0.032 0.034 0.034
K=
=
=1.1;
答:该温度下反应的平衡常数为1.1;
(4)其它条件相同时,在温度为T1和T2(T1>T2)时分别发生反应,降温平衡向逆反应方向移动,T2时,NO的转化率降低,达到平衡所需时间增长,故图象为: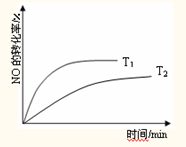 ;
;
答:T2时,NO的转化率随时间变化的示意图为 .
.
| △c |
| △t |
| (0.1-0.04)mol/L |
| 20min |
故答案为:0.003 mol?L-1?min-1;逐渐减小,但不为零;
(2)A.升高温度,平衡向正反应方向移动,NO的转化率增大,故A正确;
B.反应前后,气体体积不变,增大压强,平衡不移动,故B错误;
C.分离出N2,平衡向正反应方向移动,NO的转化率增大,故C正确;
D.使用催化剂,平衡不移动,故D错误;
故答案为:AC;
(3)C(s)+2NO(g)?N2(g)+CO2(g)
起始浓度(mol/L):0.100 0 0
转化浓度(mol/L):0.068 0.034 0.034
平衡浓度(mol/L):0.032 0.034 0.034
K=
| c(N2)c(CO2) |
| c2(NO) |
| 0.034×0.034 |
| 0.0322 |
答:该温度下反应的平衡常数为1.1;
(4)其它条件相同时,在温度为T1和T2(T1>T2)时分别发生反应,降温平衡向逆反应方向移动,T2时,NO的转化率降低,达到平衡所需时间增长,故图象为:
 ;
;答:T2时,NO的转化率随时间变化的示意图为
 .
.
点评:本题考查了化学平衡常数及化学平衡移动的影响因素、原电池电极反应式的书写、氧化还原反应、溶度积规则等,题目难度中等.

练习册系列答案
相关题目
如图为Fe+CuSO4=FeSO4+Cu中电子转移关系图,元素甲、乙分别表示( )


| A、Cu、Fe |
| B、Fe、Cu |
| C、Fe、O |
| D、Fe、S |
下列各组离子或分子在指定的溶液中一定能大量共存的是( )
| A、在含Fe2+的溶液中:Cl-、S2-、K+、I- |
| B、在c(H+)=0.01 mol?L-1的溶液中:Cu2+、Br-、SO42-、NH4+ |
| C、在使甲基橙呈红色的溶液中:Mg2+、Cl-、S2O32-、Na+ |
| D、在无色溶液中:Cr2O72-、K+、H+、CH3OH |
某活动小组探究有关因素对H2O2分解反应速率的影响.设计如下四组实验:根据以上设计,下列说法正确的是( )
| 实验编号 | 温度/℃ | H2O2溶液浓度 | 加入的其它物质 |
| ① | 25 | 5% | -- |
| ② | 50 | 10% | -- |
| ③ | 25 | 5% | MnO2 |
| ④ | 50 | 10% | FeCl3 |
| A、实验①和②可探究温度对该反应速率的影响 |
| B、实验①和②可探究H2O2溶液浓度对该反应速率的影响 |
| C、实验①和③可探究催化剂MnO2对该反应速率的影响 |
| D、实验③和④可比较MnO2和FeCl3两种催化剂对该反应速率的影响 |
 如图所示,甲是刚浸过的NaCl溶液的石蕊试纸,A、B两铜片通过导线连接电源两极,在铜片间的滤纸上滴一滴KMnO4溶液,通电一段时间后,发现AB两极间的紫红色圆点向A极移动了一段距离,则与A相连的是电源的
如图所示,甲是刚浸过的NaCl溶液的石蕊试纸,A、B两铜片通过导线连接电源两极,在铜片间的滤纸上滴一滴KMnO4溶液,通电一段时间后,发现AB两极间的紫红色圆点向A极移动了一段距离,则与A相连的是电源的