题目内容
(6分)已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下向20mL0.01mol/LCH3COOH溶液中逐滴加入0.01mol/L KOH溶液,其pH变化曲线如下图所示(忽略温度变化)。请回答下列有关问题:
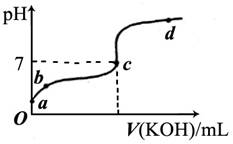
(1)a点溶液中c(H+)为 。
(2)b点溶液中离子浓度的大小顺序可能有 种情况。
(3)a、b、c三点中水的电离程度最大的是 。
【答案】
(1)4×l0-4 (2)3 (3)c
(2)3 (3)c
【解析】
试题分析:(1)K= ,溶液中的c(CH3COO-)=c(H+),所以c(H+)=
,溶液中的c(CH3COO-)=c(H+),所以c(H+)= =4×l0-4
=4×l0-4  。
。
(2)b点溶液呈酸性,则可能是c(CH3COO-)>c(H+)>c(K+)>c(OH-)或c(CH3COO-)>c(K+))>c(H+)>c(OH-)或c(CH3COO-)>c(H+)=c(K+)>c(OH-)三种情况。
(3)酸或碱抑制水的电离,有弱的盐促进水的电离,所以c点水的电离程度最大。
考点:弱电解质的电离
点评:本题难度较大,由电离平衡常数求c(H+)时,要注意忽略已电离的酸。

练习册系列答案
相关题目
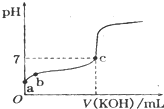 已知某温度下CH3COOH的电离常数k=1.6×10-5,该温度下向20mL 0.01mol?L-1 CH3COOH溶液中逐滴加入0.01mol?L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化),请回答有关问题.
已知某温度下CH3COOH的电离常数k=1.6×10-5,该温度下向20mL 0.01mol?L-1 CH3COOH溶液中逐滴加入0.01mol?L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化),请回答有关问题.