题目内容
9.化学在解决雾霾污染中有着重要的作用,雾霾由多种污染物形成,其中包含颗粒物(包括PM2.5)、氮氧化物(NOx)、CO、SO2等.(1)已知:NO(g)+$\frac{1}{2}$O2(g)?NO2(g)△H=-56.5kJ•mol-1
2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1.
一定条件下,将NO2与SO2以体积比1:2置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的有b.
a.混合气体的平均相对分子质量 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1mol SO3的同时生成1mol NO2
(2)CO综合利用.
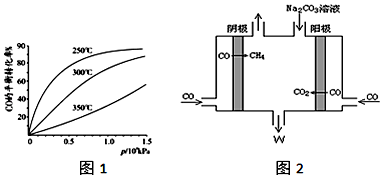
①CO用于合成甲醇反应方程式为:CO(g)+2H2(g)?CH3OH(g),若起始投入1molCO,2mol H2,CO在不同温度下的平衡转化率与压强的关系如图1.得知该反应△H<0,该反应实际生产条件控制在250℃、1.3×104kPa左右最为适宜.
②电解CO制备CH4,电解质为碳酸钠溶液,工作原理如图2所示,写出阴极区电极反应式CO+6e-+5H2O=6OH-+CH4.
分析 (1)利用盖斯定律计算反应热,得到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变;
(2)①图象分析可知压强一定,温度升高CO转化率减小,说明升温平衡逆向进行,逆向是吸热反应,温度在250°一氧化碳转化率高,反应速率大;
②由此电解原理可知,阳极失去电子生成二氧化碳气体,加入碳酸钠,碳酸钠与二氧化碳反应生成碳酸氢钠,阴极CO得到电子生成甲烷气体.
解答 解:(1)①NO(g)+$\frac{1}{2}$O2(g)?NO2(g)△H=-56.5kJ•mol-1
②2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1,$②×\frac{1}{2}-①$得,NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1,
a.随反应:NO2(g)+SO2(g)?SO3(g)+NO(g)的进行,气体的质量和物质的量都不变,混合气体的平均相对分子质量始终不变,不能说明到达平衡状态,故a错误;
b.混合气体颜色保持不变,说明二氧化氮的浓度不变,说明到达平衡状态,故b正确;
c.随反应进行,SO3和NO都是生成物,所以体积比一直等于系数比,所以SO3和NO的体积比保持不变,不能说明到达平衡状态,故c错误;
d.每生成1molSO3的同时消耗1molNO2都表示逆反应速率,反应自始至终都按此比例进行,故d错误;
故答案为:-41.8;b;
(2)①图象分析可知压强一定,温度升高CO转化率减小,说明升温平衡逆向进行,逆向是吸热反应,正向为放热反应,△H<0,图象分析可知,温度在250°一氧化碳转化率高,反应速率大,
故答案为:<;250;
②由此电解原理可知,阳极失去电子生成二氧化碳气体,加入碳酸钠,碳酸钠与二氧化碳反应生成碳酸氢钠,阴极CO得到电子生成甲烷气体,据此离子反应方程式为:4CO+3CO32-+5H2O=6HCO3-+CH4↑,阴极区电极反应式为:CO+6e-+5H2O=6OH-+CH4,
故答案为:CO+6e-+5H2O=6OH-+CH4.
点评 本题考查较为综合,为高考常见题型,侧重于学生的分析能力、计算能力的考查,题目涉及热化学方程式书写,化学平衡影响因素分析判断,原电池原理和电极反应书写方法,题目难度中等.

 阅读快车系列答案
阅读快车系列答案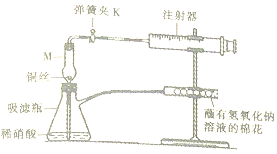 某化学兴趣小组对铜与硝酸的反应进行下列探究.
某化学兴趣小组对铜与硝酸的反应进行下列探究.I.验证铜与稀硝酸反应生成的气体为NO如图1.
(1)仪器M的名称为干燥管
(2)完成下列表格.
| 操作步骤 | 实验现象 | 解释 |
| 打开弹簧夹K,拉注射器推筒,使稀硝酸吸到干燥管中并充满干燥管在关闭弹簧夹K | 仪器M中有无色气体 | 反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O |
| 打开弹簧夹K,使干燥管中无色气体进入注射器中 | 注射器中有红棕色气体 | 反应的化学方程式为2NO+O2=NO2 |
已知:
①NO+NO2+2OH-═2NO2-+H2O
②NO2、NO气体液化的温度如表.
| 气体 | NO2 | NO |
| 液化温度 | 21℃ | -152℃ |
(4)检查装置气密性后,再加入试剂,在反应前应进行的操作是通入氮气使装置中的空气排出目的是防止NO与空气中的氧气反应生成二氧化氮.
| A. | 原子半径:X>Y>Z>W | B. | 单质沸点:W>Y>Z | ||
| C. | 简单氢化物的还原性:Y>Z>W | D. | W、X、Z的离子均能促进水的电离 |

| A. | 用装置甲制取NH3 | B. | 用装置乙制备Al(OH)3 | ||
| C. | 用装置丙进行过滤操作 | D. | 用装置丁灼烧Al(OH)3 |
| 难容电解质 | AgCl | AgBr | Agl | Ag2SO4 | Ag2CrO4 |
| Ksp | 1.8×10-10 | 5.4×10-13 | 8.5×10 -17 | 1.4×10-5 | 1.12×10-12 |
| A. | 由溶度积常数可以判断相应物质的溶解性大小 | |
| B. | 将等体积的 4×10-3 mol/L 的 AgNO3 溶液和 4×10-3 mol/L K2CrO4溶液混合,有 Ag2CrO4沉淀产生 | |
| C. | 向 AgCl 的悬浊液中滴加饱和 NaBr 溶液不能得到黄色 AgBr | |
| D. | 向 100 mL 0.02mol/L 的 NaSO4 溶液中加入 100mL0.02mol/L 的 AgNO3 溶液,有白色沉淀生成 |
| A. | 有机玻璃、涤纶、蚕丝、人造丝都属于高分子化合物 | |
| B. | C5H11Cl有8种同分异构体(不考虑立体异构) | |
| C. | 实验室用苯与浓硝酸在常温下发生硝化反应制备硝基苯 | |
| D. | 通过煤的干馏和石油的催化重整可获得芳香烃 |
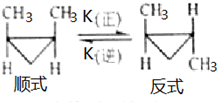 顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如图转化:
顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如图转化: 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应: