题目内容
11.X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和.下列叙述正确的是( )| A. | 原子半径的大小顺序:r(X)>r(Y)>r(Z)>r(R) | |
| B. | 含有Y、Z、R三种元素的化合物最多只有2种 | |
| C. | 元素R和Y形成的化合物RY2是一种高效安全灭菌消毒剂 | |
| D. | Y与Z能形成Z2Y和Z2Y2两种不同的化合物,它们的晶体类型相同 |
分析 X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,最外层电子数不超过8个,则其K层为次外层,则X是C元素;Y元素在地壳中的含量最多,则Y是O元素;Z元素的化合物的焰色反应呈黄色,则Z是Na元素;R原子的核外电子数是X原子与Z原子的核外电子数之和,则R的核外电子数是17,所以R是Cl元素,据此分析.
解答 解:X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,最外层电子数不超过8个,则其K层为次外层,则X是C元素;Y元素在地壳中的含量最多,则Y是O元素;Z元素的化合物的焰色反应呈黄色,则Z是Na元素;R原子的核外电子数是X原子与Z原子的核外电子数之和,则R的核外电子数是17,所以R是Cl元素,
A.原子的电子层数越多,其原子半径越大,同一周期中,元素的原子半径随着原子序数的增大而减小,C、O元素位于第二周期,Na、Cl元素位于第三周期,且O元素的原子序数大于C、Cl的原子序数大于Na,所以原子半径大小顺序是r(Z)>r(R)>r(X)>r(Y),故A错误;
B.含有O、Na、Cl三种元素的化合物,有多种NaClO、NaClO3、NaClO4等,故B错误;
C.元素R和Y形成的化合物ClO2具有强氧化性,是一种高效安全灭菌消毒剂,故C正确;
D.Y、Z分别是O、Na元素,形成氧化钠和过氧化钠,都属于离子晶体,它们的晶体类型相同,故D正确;
故选CD.
点评 本题考查原子结构与元素周期律,侧重于学生的分析能力的考查,正确推断元素是解本题关键,结合元素周期律来分析解答,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列属于同位素的是( )
| A. | 红磷和白磷 | B. | ${\;}_{1}^{1}$H和${\;}_{1}^{2}$H | ||
| C. | H2O和D2O | D. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O |
19.下列有机物中,既能发生加成反应和酯化反应,又能发生氧化反应的是( )
| A. | CH3CH2COOH | B. | CH3CH2CH2OH | C. | CH2CHCOOCH3 | D. | HOCH2CH2CHO |
16.现有部分短周期元素的性质或原子结构如表:
(1)用化学用语回答下列问题:
①A元素在周期表中的位置第三周期第ⅥA族;②C单质分子的电子式 ;
;
③D的原子结构示意图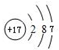 ;④电子式表示A和B元素组成的化合物的形成过程:
;④电子式表示A和B元素组成的化合物的形成过程: .
.
(2)元素D与元素A相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bde(填选项序号).
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A最高价含氧酸的酸性弱于D最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)X是由A、B、C、D四种元素中的某种元素组成的单质,能经图所示的过程转化为(其他条件略去).
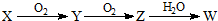
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,无现象,然后滴加适量H2O2溶液,有白色沉淀生成,则该白色沉淀为BaSO4,试写出Y与H2O2溶液反应的化学方程式:SO2+H2O2=H2SO4;
②若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为1:2.
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
①A元素在周期表中的位置第三周期第ⅥA族;②C单质分子的电子式
 ;
;③D的原子结构示意图
 ;④电子式表示A和B元素组成的化合物的形成过程:
;④电子式表示A和B元素组成的化合物的形成过程: .
.(2)元素D与元素A相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bde(填选项序号).
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A最高价含氧酸的酸性弱于D最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)X是由A、B、C、D四种元素中的某种元素组成的单质,能经图所示的过程转化为(其他条件略去).
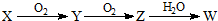
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,无现象,然后滴加适量H2O2溶液,有白色沉淀生成,则该白色沉淀为BaSO4,试写出Y与H2O2溶液反应的化学方程式:SO2+H2O2=H2SO4;
②若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为1:2.
3.光纤广泛应用于现代通讯,制造光导纤维的基本原料是( )
| A. | CuO | B. | Al2O3 | C. | CaO | D. | SiO2 |
20.下列关于原电池的叙述正确的是( )
| A. | 原电池中电子流出的一极是正极 | |
| B. | 原电池是将化学能转变为电能的装置 | |
| C. | 构成原电池的正极和负极必须是两种不同的金属 | |
| D. | 原电池放电时,电流的方向是从负极到正极 |
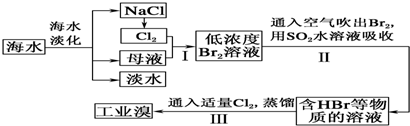
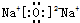
 2NH3(g)△H=-92.4KJ•mol-1
2NH3(g)△H=-92.4KJ•mol-1