题目内容
下列事实与氢键有关的是
| A.HF、HCl、HBr、HI的热稳定性依次减弱 |
| B.水加热到很高的温度都难以分解 |
| C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 |
| D.水结成冰体积膨胀 |
D
解析试题分析:A选项错误,HF、HCl、HBr、HI的热稳定性与F、Cl、Br、I的非金属性有关,非金属性越强,其氢化物越稳定,同一主族的元素,非金属性随着原子序数的增加而减小,所以其氢化物的热稳定性逐渐减弱,与氢键无关。B选项,错误。H2O较稳定是由于H-O键键能较大,与氢键无关。C选项错误。CH4、SiH4、GeH4、SnH4熔点随相对分子质量增加而升高,分子结构相似的,相对分子质量越大熔点越高,与氢键无关。D选项正确。冰中存在氢键,其体积变大,则相同质量时冰的密度比液态水的密度小
考点:含有氢键的物质

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
短周期元素X、Y、Z的原子序数依次递增,其原予的最外层电子数之和为13,X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍,下列说法正确的是( )
| A.X的氢化物溶于水生成弱酸 |
| B.Y与X可生成Y3X2型化合物 |
| C.Z的氢化物的水溶液在空气中存放不易变质 |
| D.Z的单质在氧气中燃烧可以生成两种酸性氧化物 |
短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是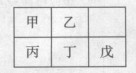
| A.原子半径:丙<丁<戊 |
| B.元素金属性:甲>丙 |
| C.氢氧化物碱性:丙<丁<戊 |
| D.丙的最高价氧化物水化物与戊的最高价氧化物水化物能发生反应 |
现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。则下列有关比较中正确的是 ( )
| A.第一电离能:④>③>②>① | B.原子半径:④>③>②>① |
| C.电负性:④>③>②>① | D.最高正化合价:④>③=②>① |
根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
| A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等 |
| B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 |
| C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 |
| D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等 |
根据电子排布的特点,铜元素在周期表属于
| A.s区 | B.p区 | C.d 区 | D.ds区 |
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价的绝对值相等,Z的核电荷数是Y的2倍,W的最外层电子数是其最内层电子数的3倍。下列说法不正确的是
| A.原子半径:Z>W>R |
| B.对应的氢化物的热稳定性:R>W |
| C.W与X、W与Z形成的化合物的化学键类型完全相同 |
| D.Y的最高价氧化物对应的水化物是弱酸 |
下列说法中正确的是
| A.第ⅤA族与第ⅦA族的短周期元素的原子间构成的所有分子,其原子均满足最外层8电子结构 |
| B.第ⅠA族元素单质熔沸点随着核电荷数的递增而升高 |
| C.因为F的非金属性强于Cl,所以HF的酸性强于HCl |
| D.离子半径:r(S2-)>r(O2-)>r(Na+)>r(Al3+) |