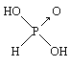
题目内容
【题目】利用如图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑。下列说法正确的是( )
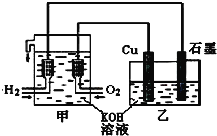
A.乙中Cu电极的电极反应式是:2Cu+2OH--2e-=Cu2O+H2O
B.甲中通入氧气的电极为负极
C.乙中阴离子向石墨电极移动
D.电路上通过0.5mol电子,可制得0.5molCu2O
【答案】A
【解析】
甲装置是燃料电池,负极上电极反应式为H2+2OH-+2e-=2H2O,正极上电极反应式为O2+2H2O+4e-=4OH-,乙装置为电解池,铜为阳极,阳极上电极反应式为2Cu+2OH--2e-=Cu2O+H2O,石墨为阴极,阴极上电极反应式为2H++2e-=H2↑,据此分析解答。
甲中通入氧气的电极是正极、通入氢气的电极是负极,所以乙中Cu是阳极、石墨是阴极。
A.乙中Cu电极上Cu失电子发生氧化反应,所以Cu的电极反应式是:2Cu+2OH--2e-=Cu2O+H2O,故A正确;
B.甲中通入氧化剂的电极是正极,所以通入氧气的电极是正极,故B错误;
C.电解池中阴离子向阳极移动,则阴离子向Cu电极移动,故C错误;
D.根据2Cu+2OH--2e-=Cu2O+H2O,电路上通过0.5mol电子,可制得0.25molCu2O,故D错误;
故选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如表所示。下列判断中,正确的是( )
密闭容器体积/L | 甲 | 乙 | 丙 | 丁 | |
2 | 2 | 2 | 1 | ||
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率/% | 80 | α1 | α2 | α3 | |
A.甲中反应的平衡常数小于乙
B.该温度下,甲和乙中反应的平衡常数K均为400
C.SO2的平衡转化率:α1>α2=α3
D.容器中SO3的物质的量浓度:丙>甲=丁
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
A | B | C | D | |
图示 |
|
|
|
|
相关 信息 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A.AB.BC.CD.D