题目内容
【题目】下列说法正确的是
A.25℃时,将pH=a的一元强酸溶液与pH=14﹣a的一元碱溶液等体积混合后,所得溶液呈酸性或中性
B.向醋酸钠溶液中加盐酸至溶液呈中性,则c(Clˉ)=c(CH3COOH)
C.常温下,已知CH3COOH的电离平衡常数为Ka、CH3COONa的水解平衡常数为Kh、则Ka·Kw=Kh
D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液中c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
【答案】B
【解析】
A.25℃时,若碱为一元弱碱,则pH=14-a的该碱浓度要大于pH=a的一元强酸,所以等体积混合是碱过量,溶液显碱性,故A错误;
B.向醋酸钠溶液中加盐酸至溶液呈中性,溶液中存在电荷守恒c(Clˉ)+ c(OHˉ)+ c(CH3COOˉ)= c(H+)+ c(Na+),溶液显中性,所以c(OHˉ)= c(H+),则c(Clˉ)+(CH3COOHˉ)= c(Na+),溶液中同时存在物料守恒c(CH3COOH)+(CH3COOˉ)= c(Na+),所以有c(Clˉ)=c(CH3COOH),故B正确;
C.CH3COOH的电离平衡常数Ka=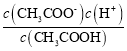 ,CH3COONa的水解平衡常数为Kh=
,CH3COONa的水解平衡常数为Kh=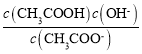 ,所以Ka·Kh= Kw,故C错误;
,所以Ka·Kh= Kw,故C错误;
D. NH4HSO4中滴加NaOH溶液,若二者物质的量相同时,溶质为等物质的量的(NH4)2SO4和Na2SO4,此时溶液呈酸性,需要再滴加少许NaOH呈中性,所以c(Na+)> c(![]() ),而溶液中存在电荷守恒c(Na+)+c(
),而溶液中存在电荷守恒c(Na+)+c(![]() )+c(H+)= 2c(
)+c(H+)= 2c(![]() )+c(OH-),溶液呈中性所以c(Na+)+c(
)+c(OH-),溶液呈中性所以c(Na+)+c(![]() )=2c(
)=2c(![]() ),所以c(Na+)> c(
),所以c(Na+)> c(![]() )>c(
)>c(![]() ),故D错误;
),故D错误;
故答案为B。

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目