题目内容
几种短周期元素的原子半径及主要化合价如下表,由此可知( )
| 元素代号 | X | Y | Z | W |
| 原子半径/nm | 0.186 | 0.089 | 0.074 | 0.099 |
| 主要化合价 | +1 | +2 | -2 | +7、-1 |
| A、X、Y元素的金属性:X<Y |
| B、X、Z形成的化合物中一定不含共价键 |
| C、W的最高价氧化物的水化物是一种强酸 |
| D、离子半径:X+>Z2- |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:W元素化合价有+7价和-1价,应为Cl,Z元素化合价为-2价,为第ⅥA族元素,且原子半径小于Cl,则应为O,Y化合价为+2价,为第ⅡA族元素,原子半径大于O,小于Cl,应为Be,X化合价为+1价,应为第ⅠA族元素,原子半径 大于Cl,应为Na元素,结合对应单质、化合物的性质以及元素周期律解答该题.
解答:
解:W元素化合价有+7价和-1价,应为Cl,Z元素化合价为-2价,为第ⅥA族元素,且原子半径小于Cl,则应为O,Y化合价为+2价,为第ⅡA族元素,原子半径大于O,小于Cl,应为Be,X化合价为+1价,应为第ⅠA族元素,原子半径 大于Cl,应为Na元素,
A.由同周期元素从左到右元素的金属性逐渐减弱,同主族从上到下元素的金属性逐渐增强可知金属性Na>Be,故A错误;
B.X、Z形成的化合物Na2O2中含共价键,故B错误;
C.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,W的最高价氧化物的水化物为HClO4,是一种强酸,故C正确;
D.X+、Z2-具有相同的核外电子排布,核电荷数越大,离子半径越小,故D错误.
故选C.
A.由同周期元素从左到右元素的金属性逐渐减弱,同主族从上到下元素的金属性逐渐增强可知金属性Na>Be,故A错误;
B.X、Z形成的化合物Na2O2中含共价键,故B错误;
C.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,W的最高价氧化物的水化物为HClO4,是一种强酸,故C正确;
D.X+、Z2-具有相同的核外电子排布,核电荷数越大,离子半径越小,故D错误.
故选C.
点评:本题考查元素位置结构和性质的关系及应用,题目难度中等,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键,注意元素周期律的递变规律的应用.

练习册系列答案
相关题目
下列说法正确的是( )
| A、CH3CH2CH2CH3的二氯取代产物只有5种结构 |
| B、油脂的种类很多,但它们水解后都有一相同产物 |
| C、乙烯、苯、纤维素均属于烃类化合物 |
| D、苯和乙烯都能使溴水层褪色,均与溴水发生加成反应 |
下列实验过程和过程中涉及的离子反应方程式正确的是( )
| A、除去硫酸铜溶液中的硫酸亚铁以最终制备胆矾晶体:2Fe2++Cl2═2Fe3++2Cl- |
| B、Fe(OH)3与氢溴酸溶液混合:Fe(OH)3+3HBr═Fe3++3Br-+3H2O |
| C、用氨水吸收烟道气中的SO2:SO2+2NH3?H2O═2NH4++SO32-+H2O |
| D、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
下列说法正确的是( )
| A、纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 |
| B、油脂都不能使溴的四氯化碳溶液褪色 |
| C、石油分馏、煤的干馏均为物理变化 |
| D、提纯鸡蛋白中的蛋白质时,可向鸡蛋清溶液中加入浓硫酸铵溶液,然后将所得沉淀滤出,经洗涤即得到较纯净的蛋白质 |
下列有关化学用语使用正确的是( )
A、羟基乙酸(HOCH2COOH)的缩聚物: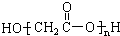 |
B、H2O2的分子结构模型示意图: |
| C、在CS2、PCl5中各原子最外层均能达到8电子的稳定结构 |
| D、淀粉和纤维素的实验式都为 CH2O |
五种短周期元素(用字母表示)在周期表中的相对位置如下,其中Y的单质在空气中含量最高.下列判断正确的是( )
| X | Y | ||
| Z | M | R |
| A、气态氢化物稳定性:X>Y |
| B、最高价氧化物的水化物的酸性:Y>M |
| C、R的氧化物的水化物是离子化合物 |
| D、Z、M、R的原子半径依次减小,最高化合价依次升高 |
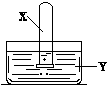 将装满气体X的试管倒置于装有液体Y的水槽中,下列说法合理的是( )
将装满气体X的试管倒置于装有液体Y的水槽中,下列说法合理的是( ) 常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等.
常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等.