题目内容
5.反应3Cl2+8NH3=6NH4Cl+N2常用于判断氯气管道是否漏气,关于该反应的说法正确的是( )| A. | Cl2发生氧化反应 | |
| B. | NH3是还原剂 | |
| C. | 每生成1 mol N2,转移3 mol电子 | |
| D. | 被氧化与未被氧化的NH3物质的量之比为1:3 |
分析 反应3Cl2+8NH3═N2+6NH4Cl中,Cl元素化合价降低,被还原,Cl2为氧化剂,N元素化合价升高,被氧化,NH3为还原剂,NH3与HCl反应生成氯化铵,有白烟生成,以此解答.
解答 解:A、反应中Cl2为氧化剂,发生还原反应,故A错误;
B、反应中Cl2为氧化剂,NH3为还原剂,故B正确;
C、每生成1 mol N2,有6mol×(1-0)=6mol电子转移,故C错误;
D、3Cl2+8NH3═6NH4Cl+N2反应中有8mol氨参加反应,2mol是还原剂,还有6mol未被氧化,所以被氧化与未被氧化的NH3物质的量之比为1:3,故D正确;
故选BD.
点评 本题以氨气的性质考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应及转移电子的考查,题目难度不大.

练习册系列答案
相关题目
4.下列气体不能用排水法收集的是( )
| A. | NO | B. | SO2 | C. | O2 | D. | CO |
16.下列说法中正确的是( )
| A. | 干冰与二氧化硅晶体熔化时,所克服的微粒间相互作用相同 | |
| B. | 晶体的熔点由高到低排列顺序为SiO2、CsCl、CBr4、CF4 | |
| C. | 1molNaCl中有NA个NaCl分子 | |
| D. | 任何晶体中,若含有阳离子就一定含有阴离 |
13.下列有关纯净物、混合物、电解质、非电解质的正确组合为( )
| 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 纯盐酸 | 水煤气 | 硫酸 | 干冰 |
| B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
| C | 胆矾 | 氢氧化铁胶体 | 铁 | 碳酸钙 |
| D | 水银 | 澄清石灰水 | 氯化铜 | 碳酸钠 |
| A. | A | B. | B | C. | C | D. | D |
20.能产生丁达尔效应的分散系是( )
| A. | CuSO4溶液 | B. | 盐酸 | C. | Fe(OH)3胶体 | D. | KOH溶液 |
17.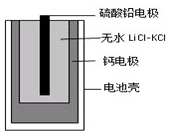 热激活电池可用作火箭、导弹的工作电池.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池的总反应方程式为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb.
热激活电池可用作火箭、导弹的工作电池.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池的总反应方程式为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb.
下列有关说法正确的是( )
 热激活电池可用作火箭、导弹的工作电池.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池的总反应方程式为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb.
热激活电池可用作火箭、导弹的工作电池.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池的总反应方程式为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb.下列有关说法正确的是( )
| A. | 正极反应式:Ca+2Cl--2e-=CaCl2 | |
| B. | 放电过程中,Li+向钙电极移动 | |
| C. | 外电路中,电子由硫酸铅电极经导线流向钙电极 | |
| D. | 常温时,在正负极间接上电流表或检流计,指针不偏转 |
14.以下转化不能通过置换反应实现的是( )
| A. | Na→H2 | B. | Cu→CuCl2 | C. | Cl2→NaCl | D. | CuO→Cu |
10.下列有关气体摩尔体积的描述正确的是( )
| A. | 通常状况下的气体摩尔体积约为22.4L | |
| B. | 标准状况下的气体摩尔体积约为22.4L | |
| C. | 相同物质的量的气体气体摩尔体积相同 | |
| D. | 同温同压的气体气体摩尔体积相同 |
