题目内容
有两种气体单质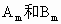 ,已知2.4g
Am和2.1g Bn含相同原子数,分子个数之比为2∶3,又知A和B核内质子数与中子数都相等,且A原子中的L电子层所含电子数是K层电子数的3倍,试推断:
,已知2.4g
Am和2.1g Bn含相同原子数,分子个数之比为2∶3,又知A和B核内质子数与中子数都相等,且A原子中的L电子层所含电子数是K层电子数的3倍,试推断:
(1)元素符号:A_______;B_______.(2)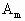 中m=_______,
中m=_______,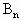 中n=_______.
中n=_______.
(3)写出A的单质可能的分子式_______.
答案:
解析:
提示:
解析:
|
(1)O,N;(2)3,2;(3) |
提示:
|
A原子的L层电子数为K层电子数的3倍,所以A原子L层有6个电子,K层有2个电子.A为8号元素,即为氧元素,原子量=16. 因为 所以A、B两种原子的相对原子质量之比为: 已知A的相对原子质量为16,则B的相对原子质量为14. 又因为B中质子数与中子数相等,所以B中质子数为7,B为氮元素. B原子的质子数=中子数,所以B原子的质子数=14÷2=7,B为氮元素. |

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
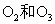
 含相同原子数;
含相同原子数;