题目内容
18.下列元素肯定属于主族元素的是( )| A. | 最高正价为+7价的一种元素 | |
| B. | 最外电子数为2的元素 | |
| C. | 原子L层比M层多6个电子的一种元素 | |
| D. | 最外层电子数为8的一种元素 |
分析 A、ⅦA族元素最高价正化合价为+7(F除外),但过渡元素中很多元素化合价可能为+7;
B、氦最外层2个电子;
C、原子L层比M层多6个电子,则M层电子数为2,该元素为Mg;
D、最外层电子数为8的元素为零族元素.
解答 解:A.ⅦA族元素最高价正化合价为+7(F除外),但过渡元素中很多元素化合价可能为+7,故A错误;
B.Cu、Zn元素除最外层电子外,其余各层都达到饱和,二者属于副族元素,故B错误;
C.原子L层比M层多6个电子,则M层电子数为2,该元素为Mg,为主族元素,故C正确;
D.最外层电子数为8的元素为稀有气体元素,故D错误,
故选C.
点评 本题考查元素周期表的结构及其应用,学生在掌握元素周期表结构的同时要对元素的特殊性有充分的把握,比较容易.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
8.在容积不变的密闭容器中加入1mol N2和3mol H2反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,下列结论正确的是( )
| A. | 该反应达到平衡时,放出的热量等于92.4kJ | |
| B. | 达到平衡后向容器中通入1mol氦气,容器内压强增大,平衡向右移动 | |
| C. | 降低温度和缩小容器体积均可使该反应的平衡常数增大 | |
| D. | 若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的90% |
9.用标准的碱液滴定某酸时,下列操作错误的是( )
| A. | 滴定时眼睛应注视锥形瓶 | B. | 锥形瓶用待测液润洗2-3次 | ||
| C. | 滴定时不断地摇动锥形瓶 | D. | 滴定前排出管内液体中的气泡 |
6.由反应物X转化为Y或Z的能量变化如图所示.下列说法正确的是( )
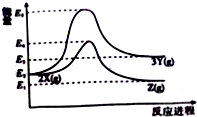

| A. | 由X→Y反应的△H=E5-E2 | |
| B. | 升高温度有利于提高Z的产率 | |
| C. | 由X→Y的反应,增加压强有利于提高X的转化率 | |
| D. | 由X→Z反应的△H<0 |
13.下列离子方程式中,只能表示一个化学反应的是( )
①Ag++Cl-═AgCl↓
②Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O
③CO32-+2H+═CO2↑+H2O
④Fe+Cu2+═Fe2++Cu.
①Ag++Cl-═AgCl↓
②Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O
③CO32-+2H+═CO2↑+H2O
④Fe+Cu2+═Fe2++Cu.
| A. | ①③ | B. | ②④ | C. | ②③ | D. | 没有 |
3.下列分离或提纯有机物的方法正确的是( )
| 选项 | 待提纯物质 | 杂质 | 除杂试剂及主要操作方法 |
| A | 苯 | 溴单质 | 加亚硫酸钠溶液洗涤,分液 |
| B | 淀粉胶体 | 葡萄糖 | 水,过滤 |
| C | 甲烷 | 乙烯 | 通入酸性高锰酸钾溶液,洗气 |
| D | 乙酸乙酯 | 乙酸 | 加入氢氧化钠溶液,分液 |
| A. | A | B. | B | C. | C | D. | D |
10.如图所示,有关化学反应和能量变化的说法正确的是( )


| A. | 图a表示的是吸热反应的能量变化 | |
| B. | 图b中反应物比生成物稳定 | |
| C. | 图b可以表示氧化钙与水反应的能量变化 | |
| D. | 图a不需要加热就一定能发生,图b一定需要加热才能发生 |
7.设NA为阿伏加德罗常数值.下列有关叙述正确的是( )
| A. | 1 molN2与4 mol H2反应生成的NH3分子数为2NA | |
| B. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| C. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3NA | |
| D. | 11.2 L标况下的SO3所含分子数为0.5NA |
8.合成氨反应:3H2+N2=2NH3其反应速率可以分别用v(H2)、v(N2)、v(NH3)[单位均为mol/(L•s)]表示,则正确的关系是( )
| A. | v(H2)=v(N2)=v(NH3) | B. | v(H2)=v(NH3) | C. | 2v(N2)=v(NH3) | D. | v(N2)=3v(H2) |