题目内容
3.将等物质的量的SO2和Cl2混合后的气体溶解于适量的蒸馏水中,再滴入含有品红和BaCl2的混合溶液,则发生的实验现象是( )①红色溶液很快褪色 ②红色溶液不褪色 ③有白色沉淀生成 ④没有白色沉淀生成.
| A. | 仅①和④ | B. | 仅①和③ | C. | 仅②和③ | D. | 仅②和④ |
分析 将等物质的量的SO2和Cl2反应生成盐酸和硫酸,依据盐酸和硫酸的性质判断发生反应及现象,据此解答.
解答 解:等物质的量的SO2和Cl2混合后的气体溶解于适量的蒸馏水中,发生:SO2+Cl2+2H2O=2HCl+H2SO4,
生成盐酸和硫酸都不具有漂白性,所以不能使品红溶液褪色,硫酸与氯化钡反应生成硫酸钡沉淀,所以会产生白色沉淀,
故选C.
点评 本题考查氯气和二氧化硫的反应,明确二者发生反应及生成物的性质是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.2SO2(g)+O2(g)?2SO3(g)(正反应放热).下列有关说法正确的是( )
| A. | 若降低温度,可以加快反应速率 | |
| B. | 使用催化剂是为了加快反应速率 | |
| C. | 在上述条件下,SO2能完全转化为SO3 | |
| D. | 达到平衡时,SO2和SO3的浓度一定相等 |
14.下列化学用语正确的是( )
| A. | 甲烷的结构式:CH4 | B. | 溴乙烷的分子式CH3CH2Br | ||
| C. | 乙烯的结构简式CH2CH2 | D. | 苯的最简式 CH |
11.X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.
请回答下列问题:
(1)Y在元素周期表中的位置为第二周期第ⅥA族.
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),非金属气态氢化物还原性最强的是H2S(写化学式).
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有Cl2、O3、ClO2(写出其中两种物质的化学式).
(4)ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
(5)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一.元素E位于第四周期,与元素Y同主族.在如表中列出对H2EO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中E用元素符号表示)
(6)由碳元素(C)、Y和M三种元素组成的化合物CYM中,所有原子的最外层都满足8电子结构.写出该化合物的电子式(电子式中Y、M用元素符号表示)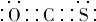 .
.
请回答下列问题:
(1)Y在元素周期表中的位置为第二周期第ⅥA族.
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),非金属气态氢化物还原性最强的是H2S(写化学式).
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有Cl2、O3、ClO2(写出其中两种物质的化学式).
(4)ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
(5)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一.元素E位于第四周期,与元素Y同主族.在如表中列出对H2EO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中E用元素符号表示)
| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2EO3+4HI═Z↓+2I2+3H2O |
| 1 | ||
| 2 |
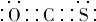 .
.
18.许多国家十分重视海水资源的综合利用,不需要化学变化就能从海水中获得的物质是( )
| A. | Cl2 | B. | Na | C. | 淡水 | D. | NaOH |
8.在一固定体积的密闭容器中加入2mol A和1mol B发生反应2A(g)+B(g)?3C(g)+D(g),达到平衡时C的浓度为w mol•L-1,若维持容器的体积和温度不变,按下列四种配比方案作为反应物,达平衡后,使C的浓度仍为w mol•L-1的配比是( )
| A. | 4 mol A+2 mol B | B. | 3 mol C+1 mol D+2mol A+1 mol B | ||
| C. | 3mol C+1 mol D+1 mol B | D. | 3 mol C+1 mol D |
15.下列措施一定能使化学反应速率加快的是( )
| A. | 增大反应物的量 | B. | 增大压强 | C. | 升高温度 | D. | 使用催化剂 |
13.胡椒酚是植物挥发油的成分之一.它的结构式为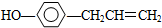 ,下列叙述中正确的是( )
,下列叙述中正确的是( )
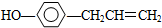 ,下列叙述中正确的是( )
,下列叙述中正确的是( )| A. | 1mol胡椒酚最多可与4mol氢气发生反应 | |
| B. | 1mol胡椒酚最多可与2mol溴发生反应 | |
| C. | 与FeCl3显紫色,因为该物质与苯酚属于同系物 | |
| D. | 胡椒酚在水中的溶解度大于苯酚在水中的溶解度 |
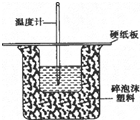 50mL 0.5mol/L盐酸和50mL 0.55mol/L烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
50mL 0.5mol/L盐酸和50mL 0.55mol/L烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题: