题目内容
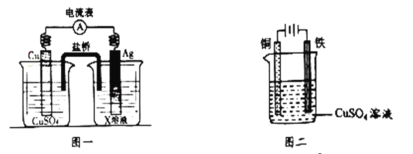
【题目】由于具有超低耗电量、寿命长的特点,LED产品越来越受人欢迎。如图是氢氧燃料电池驱动LED发光的装置。
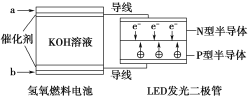
①a处通入的气体是氢气,b处通入的气体是氧气;
②该装置中只涉及两种形式的能量变化;
③电池正极的电极反应式为O2+2H2O+4e-=4OH-;
④P型半导体连接的是电池负极。上述说法中正确的是( )
A.①②B.①③C.③④D.②④
【答案】B
【解析】
①由电子流向可知a为负极,b为正极,负极上发生氧化反应,通入氢气,正极上发生还原反应,通入的是氧气,故①正确;
②该装置的能量转换有化学能、电能和光能,故②错误;
③a为负极,发生的电极反应为H22e+2OH═2H2O,b为正极发生的电极反应为O2+2H2O+4e═4OH,故③正确;
④P型半导体连接的是电池正极,故④错误;
故选B。

【题目】二甲醚被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上常采用甲醇气相脱水法来获取。其反应方程式为:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
完成下列填空:
28、有机物分子中都含碳元素,写出碳原子最外层电子的轨道表示式_______________;
写出甲醇分子中官能团的电子式_________________。
29、碳与同主族的短周期元素相比,非金属性较强的是_________(填元素符号)。写出一个能证明你的结论的化学方程式_____________________________________。
30、在温度和体积不变的情况下,能说明反应已达到平衡状态的是______(选填编号)
a.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
b.容器内压强保持不变
c.H2O(g)浓度保持不变
d.气体平均相对分子质量保持不变
31、一定温度下,在三个体积约为2.0 L的恒容密闭容器中发生上述反应:
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.40 | 0.16 | 0.16 |
Ⅱ | 387 | 0.80 | a | |
Ⅲ | 207 | 0.40 | 0.18 | 0.18 |
(1)若要提高CH3OH的平衡转化率,可以采取的措施是______(选填编号)。
a.及时移走产物 b.升高温度 c.充入CH3OH d.降低温度
(2)I号容器内的反应经过t min达到平衡,则CH3OH的平均反应速率为_____________(用含t的式子表示)。II号容器中a =___________mol。
32、若起始时向容器I中充入CH3OH 0.2mol、CH3OCH3 0.30mol和H2O 0.20mol,则反应将向__________(填“正”“逆”)反应方向进行。