题目内容
 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.(1)甲同学在a、b、c三只烧杯里分别加入50mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象.
①甲同学设计实验的目的是
②反应最剧烈的烧杯是
③写出b烧杯里发生反应的离子方程式
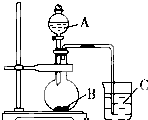
(2)乙同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了右图装置以验证碳、氮、硅元素的非金属性强弱.乙同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成.
①写出所选用物质的化学式:A、
②写出烧瓶中发生反应的化学方程式:
③写出烧杯中发生反应的化学方程式:
④碳、氮、硅元素的非金属性强弱顺序为
考点:性质实验方案的设计
专题:实验题,实验设计题
分析:(1)由“研究性学习小组设计了一组实验验证元素周期律”可知,甲同学设计实验的目的是验证锂、钠、钾的金属性强弱;金属性越强,单质与水反应越剧烈;
(2)利用强酸制备弱酸进行,A是强酸,常温下可与铜反应,为硝酸;B是块状固体,打开分液漏斗的活塞后,C中可观察到白色沉淀生成,则B为碳酸钙、C为硅酸钠,以此解答.
(2)利用强酸制备弱酸进行,A是强酸,常温下可与铜反应,为硝酸;B是块状固体,打开分液漏斗的活塞后,C中可观察到白色沉淀生成,则B为碳酸钙、C为硅酸钠,以此解答.
解答:
解:(Ⅰ) ①由“研究性学习小组设计了一组实验验证元素周期律”可知,甲同学设计实验的目的是验证锂、钠、钾的金属性强弱,
故答案为:验证锂、钠、钾的活泼性(或同一主族,从上到下元素的金属性逐渐增强);
②金属性K>Na>Li,金属性越强,单质与水反应越剧烈,故反应最剧烈的烧杯是C,故答案为:C;
③钠和水反应生成氢氧化钠和氢气,反应的离子方程式为2 Na+2H2O=2Na++2OH-+H2↑,故答案为:2 Na+2H2O=2Na++2OH-+H2↑;
(Ⅱ) ①利用强酸制备弱酸进行,A是强酸,常温下可与铜反应,硝酸;B是块状固体,打开分液漏斗的活塞后,C中可观察到白色沉淀生成,则B为碳酸钙、C为硅酸钠或硅酸钾,
故答案为:HNO3;CaCO3;Na2SiO3(或K2SiO3);
②烧瓶中发生硝酸与碳酸钙的反应,方程式为2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑,故答案为:2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑;
③二氧化碳可与硅酸钠反应生成硅酸,且生成碳酸钠,如二氧化碳过量,可生成碳酸氢钠,反应的化学方程式为CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3或2CO2+2H2O+Na2SiO3=H2SiO3↓+2NaHCO3,
故答案为:CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3或2CO2+2H2O+Na2SiO3=H2SiO3↓+2NaHCO3;
④元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,由实验可知酸性:硝酸大于碳酸,碳酸大于硅酸,则非金属性氮>碳>硅,故答案为:氮>碳>硅.
故答案为:验证锂、钠、钾的活泼性(或同一主族,从上到下元素的金属性逐渐增强);
②金属性K>Na>Li,金属性越强,单质与水反应越剧烈,故反应最剧烈的烧杯是C,故答案为:C;
③钠和水反应生成氢氧化钠和氢气,反应的离子方程式为2 Na+2H2O=2Na++2OH-+H2↑,故答案为:2 Na+2H2O=2Na++2OH-+H2↑;
(Ⅱ) ①利用强酸制备弱酸进行,A是强酸,常温下可与铜反应,硝酸;B是块状固体,打开分液漏斗的活塞后,C中可观察到白色沉淀生成,则B为碳酸钙、C为硅酸钠或硅酸钾,
故答案为:HNO3;CaCO3;Na2SiO3(或K2SiO3);
②烧瓶中发生硝酸与碳酸钙的反应,方程式为2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑,故答案为:2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑;
③二氧化碳可与硅酸钠反应生成硅酸,且生成碳酸钠,如二氧化碳过量,可生成碳酸氢钠,反应的化学方程式为CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3或2CO2+2H2O+Na2SiO3=H2SiO3↓+2NaHCO3,
故答案为:CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3或2CO2+2H2O+Na2SiO3=H2SiO3↓+2NaHCO3;
④元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,由实验可知酸性:硝酸大于碳酸,碳酸大于硅酸,则非金属性氮>碳>硅,故答案为:氮>碳>硅.
点评:本题考查性质实验方案的设计,为高频考点,侧重于学生的分析能力和实验能力的考查,本题将元素及其化合物、元素周期律与实验知识结合起来,具有较强的综合性,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A、太阳能电池板中的硅,在元素周期表中处于金属与非金属的交界位置 |
| B、煤的气化或液化技术,可以降低污染 |
| C、镁粉可用来作信号弹和烟花,氧化镁可制作耐高温材料 |
| D、NaHCO3能与碱反应,因此食品工业用小苏打做焙制糕点的膨松剂 |
实验室制乙酸乙酯1mL后,沿器壁加入紫色石蕊试液0.5mL,这时石蕊试液将存在于饱和碳酸钠溶液层与乙酸乙酯层之间(整个过程不振荡).对可能出现的现象,下列叙述中正确的是( )
| A、石蕊层仍为紫色,有机层无色 |
| B、石蕊层为三层环,由上而下是红、紫、红 |
| C、石蕊层有两层,上层为紫色,下层为蓝色 |
| D、石蕊层为三层环,由上而下是蓝、紫、红 |
 所示.
所示.

 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
 为了制取干燥纯净的气体C,可用如下图所示装置.生成C的速度可通过调节滴入液体A的速度的方法来控制,已知C是一种无色无味、不能使酸碱指示剂变色,也不会在空气中燃烧的气体.
为了制取干燥纯净的气体C,可用如下图所示装置.生成C的速度可通过调节滴入液体A的速度的方法来控制,已知C是一种无色无味、不能使酸碱指示剂变色,也不会在空气中燃烧的气体.