题目内容
同温同压下,某容器充满O2重116g,若充满CO2重122g,现充满某气体重124g,则某气体的相对分子质量为( )
| A、24 | B、32 | C、40 | D、48 |
考点:阿伏加德罗定律及推论,摩尔质量
专题:阿伏加德罗常数和阿伏加德罗定律
分析:同温同压下,气体摩尔体积相等,相同体积的气体其物质的量相等,根据m=nM知,相同物质的量时,摩尔质量越大其质量越大,据此分析解答.
解答:
解:同温同压下,气体摩尔体积相等,相同体积的气体其物质的量相等,根据m=nM知,相同物质的量时,摩尔质量越大其质量越大,相同体积的氧气、二氧化碳、某种气体,其质量分别是116g、122g、124g,说明某种气体的摩尔质量最大,大于二氧化碳摩尔质量44g/mol,故选D.
点评:本题考查阿伏伽德罗定律及其推论,明确物质的量相等时气体质量与摩尔质量的关系即可解答,化繁为简,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列事实不能用勒沙特列原理来解释的是( )
| A、红棕色的NO2,加压后颜色先变深后变浅 |
| B、高压比常压有利于合成SO3的反应 |
| C、合成NH3在较高温度下进行 |
| D、黄绿色的氯水光照后颜色变浅 |
下列说法正确的是( )
| A、化学反应中的能量变化,通常表现为热量的变化 |
| B、煤和石油属于可再生能源 |
| C、要使燃料燃烧只需要大量的氧气 |
| D、汽车排出大量尾气中含有CO会污染大气 |
 如图所示是对Na2CO3、Na2SO4、K2CO3、K2SO4四种物质进行的分类,这种分类方法的名称是( )
如图所示是对Na2CO3、Na2SO4、K2CO3、K2SO4四种物质进行的分类,这种分类方法的名称是( )| A、交叉分类法 | B、树状分类法 |
| C、圈图法 | D、链状箭头法 |
将等体积的甲烷与氯气混合于一集气瓶中,加盖后置于光亮处,下列有关此实验的现象和结论叙述不正确的是( )
| A、瓶中气体的黄绿色逐渐变浅 |
| B、瓶内壁有油状液滴形成 |
| C、若日光直射,可能发生爆炸 |
| D、生成物只有CH3Cl、CH2Cl2、CHCl3、CCl4 |
金属钠长期置于空气中,最终变成( )
| A、Na2O2 |
| B、Na2O |
| C、Na2CO3 |
| D、Na2CO3?10H2O |
在冶金厂和水泥厂常用高压电对气溶胶作用除去大量烟尘,以减少对空气的污染,这种处理方法应用的原理是( )
| A、丁达尔效应 | B、布朗运动 |
| C、电泳 | D、渗析 |
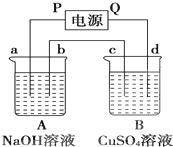 按如图装置实验,A、B两烧杯分别盛放200g10% NaOH溶液和足量CuSO4溶液.通电一段时间后,c极上有Cu析出.又测得烧杯A溶液的质量减少4.5g,电极均为石墨电极,试回答:
按如图装置实验,A、B两烧杯分别盛放200g10% NaOH溶液和足量CuSO4溶液.通电一段时间后,c极上有Cu析出.又测得烧杯A溶液的质量减少4.5g,电极均为石墨电极,试回答: