��Ŀ����
 �״�����Ҫ�Ļ���ԭ�ϣ����ճ����������Ź㷺��Ӧ�ã�
�״�����Ҫ�Ļ���ԭ�ϣ����ճ����������Ź㷺��Ӧ�ã���1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ��CO��g��+2H2��g��
 CH3OH��g����H1
CH3OH��g����H1��Ӧ��CO2��g��+3H2��g��
 CH3OH��g��+H2O��g����H2
CH3OH��g��+H2O��g����H2���������Ʊ��״���������Ӧ�У���ӦI���ڷ�ӦII��ԭ��Ϊ
��ӦI���ϡ�ԭ�Ӿ����ԡ���ԭ��ԭ��������Ϊ100%
��ӦI���ϡ�ԭ�Ӿ����ԡ���ԭ��ԭ��������Ϊ100%
�����±����������Ƿ�Ӧ���ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ������ֵ��
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
����
����
�ƶ������������������������II��ij�¶��£���1mol CO��4molH2����2L���ܱ������У���ַ�Ӧ�ﵽƽ����c��CO��=0.1mol/L����CO��ת����Ϊ
80%
80%
����ʱ���¶���
��
250�棨�����������������=������2����֪�ڳ��³�ѹ�£���2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��l����H1=-Q1kJ/mol
��2CO ��g��+O2��g��=2CO2��g����H2=-Q2 kJ/mol��H2O��g��=H2O��l����H3=-Q3 kJ/mol
��д���״���������ȫȼ������һ����̼����̬ˮ���Ȼ�ѧ��Ӧ����ʽ��
CH3OH��l��+O2��g��=CO��g��+2H2O��g����H=��2Q3+0.5Q2-0.5Q1��kJ/mol
CH3OH��l��+O2��g��=CO��g��+2H2O��g����H=��2Q3+0.5Q2-0.5Q1��kJ/mol
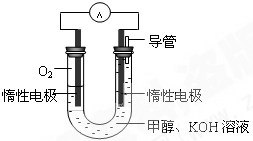
��3��ijͬѧ���ݼ״�ȼ�յķ�Ӧԭ���������ͼ��ʾ�ĵ��װ�ã�����һ��ʱ������Һ��pH��
����
����
����ߡ��������͡��������䡱������ȼ�ϵ�ظ�����Ӧ�����ӷ���ʽΪ��CH3OH-6e-+8OH-=CO32-+6H2O
CH3OH-6e-+8OH-=CO32-+6H2O
����������1���ٱȽϷ�Ӧ��͢ӷ�Ӧ���Ƿ���ȫת���Ƚ϶��ߵ����ӣ�
�ڸ����¶�����ѧƽ�ⳣ���ı仯�����жϷ�Ӧ���еķ��Ƚϳ�ʼ��ƽ���ǵķ�Ӧ������ʵ������������ĵ�CO�����ʵ�������ת���ʣ������ƽ���ƽ�ⳣ�����������ֵ�Ƚ��жϷ�Ӧ���¶ȣ�
��2�����ø�˹���ɼ��㷴Ӧ�Ȳ���д�Ȼ�ѧ����ʽ��
��3��д��ȼ�ϵ�صĵ缫����ʽ���ж���ҺPH�ı仯��
�ڸ����¶�����ѧƽ�ⳣ���ı仯�����жϷ�Ӧ���еķ��Ƚϳ�ʼ��ƽ���ǵķ�Ӧ������ʵ������������ĵ�CO�����ʵ�������ת���ʣ������ƽ���ƽ�ⳣ�����������ֵ�Ƚ��жϷ�Ӧ���¶ȣ�
��2�����ø�˹���ɼ��㷴Ӧ�Ȳ���д�Ȼ�ѧ����ʽ��
��3��д��ȼ�ϵ�صĵ缫����ʽ���ж���ҺPH�ı仯��
����⣺��1����ӦI�з�Ӧ����ȫת������������Ϊ100%�����ϡ�ԭ�Ӿ����ԡ���ԭ�ʴ�Ϊ���ٷ�ӦI���ϡ�ԭ�Ӿ����ԡ���ԭ��ԭ��������Ϊ100%��
���¶�����ѧƽ�ⳣ����С��˵����������٣���Ӧ�����࣬�ʷ�Ӧ�������ƶ�����Ӧ���ȣ��ﵽƽ��ʱ����Ӧ��CO�����ʵ���Ϊ��1mol-2L��0.2moL/L=0.8mol��ת����Ϊ
��100%=80%����ʱƽ�ⳣ��Ϊk=
=
=100��mol/L��-3���¶�С��250�棬
�ʴ�Ϊ��I������II��80%������
��2�����ݸ�˹���ɼ��㣬2����+
����-
���ٿɵü״���������ȫȼ������һ����̼����̬ˮ���Ȼ�ѧ��Ӧ����ʽ
CH3OH��l��+O2��g��=CO��g��+2H2O��g����H=��2Q3+0.5Q2-0.5Q1��kJ/mol��
�ʴ�Ϊ��CH3OH��l��+O2��g��=CO��g��+2H2O��g����H=��2Q3+0.5Q2-0.5Q1��kJ/mol��
��3����ȼ�ϵ�ص�������ӦΪ��02+4e-+2H2O�T4OH-��������ӦΪ��CH3OH-6e-+8OH-�TCO32-+6H2O���ܷ�ӦΪ��2CH3OH+302+4OH-�T2CO32-+6H2O�����ݷ�Ӧʽ��֪����һ��ʱ������Һ��pH�����ͣ��ʴ�Ϊ�����ͣ�CH3OH-6e-+8OH-�TCO32-+6H2O��
���¶�����ѧƽ�ⳣ����С��˵����������٣���Ӧ�����࣬�ʷ�Ӧ�������ƶ�����Ӧ���ȣ��ﵽƽ��ʱ����Ӧ��CO�����ʵ���Ϊ��1mol-2L��0.2moL/L=0.8mol��ת����Ϊ
| 0.8 |
| 1 |
| c(CH3OH) |
| c(CO)��c2(H2) |
| 0.4mol/L |
| 0.1mol/L��(0.2mol/L)2 |
�ʴ�Ϊ��I������II��80%������
��2�����ݸ�˹���ɼ��㣬2����+
| 1 |
| 2 |
| 1 |
| 2 |
CH3OH��l��+O2��g��=CO��g��+2H2O��g����H=��2Q3+0.5Q2-0.5Q1��kJ/mol��
�ʴ�Ϊ��CH3OH��l��+O2��g��=CO��g��+2H2O��g����H=��2Q3+0.5Q2-0.5Q1��kJ/mol��
��3����ȼ�ϵ�ص�������ӦΪ��02+4e-+2H2O�T4OH-��������ӦΪ��CH3OH-6e-+8OH-�TCO32-+6H2O���ܷ�ӦΪ��2CH3OH+302+4OH-�T2CO32-+6H2O�����ݷ�Ӧʽ��֪����һ��ʱ������Һ��pH�����ͣ��ʴ�Ϊ�����ͣ�CH3OH-6e-+8OH-�TCO32-+6H2O��
���������⿼���Ϊ�ۺϣ��漰��ɫ��ѧ����ѧƽ���ƶ���ƽ�ⳣ���ļ����Ӧ�á���˹�����Լ��绯ѧ֪ʶ����Ŀ����һ���Ѷȣ�������ע��ƽ�ⳣ����Ӧ�ú��жϣ�

��ϰ��ϵ�д�
�����Ŀ
�״�����Ҫ�Ļ���ԭ�ϣ����ճ����������Ź㷺��Ӧ�ã�
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ��CO��g��+2H2��g�� CH3OH��g����H1
CH3OH��g����H1
��Ӧ��CO2��g��+3H2��g�� CH3OH��g��+H2O��g����H2
CH3OH��g��+H2O��g����H2
���������Ʊ��״���������Ӧ�У���ӦI���ڷ�ӦII��ԭ��Ϊ______��
���±����������Ƿ�Ӧ���ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ������ֵ��
I����һ�ܱ������з�����Ӧ�ﵽƽ����������������䣬���������£��˷�Ӧ�Ļ�ѧ��Ӧƽ��Ӧ______�ƶ������������������������
II��ij�¶��£���1mol CO��4molH2����2L���ܱ������У���ַ�Ӧ�ﵽƽ����c��CO��=0.1mol/L����CO��ת����Ϊ______����ʱ���¶�______250�棨�����������������=����
��2����֪�ڳ��³�ѹ�£���2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��l����H1=-Q1kJ/mol
��2CO ��g��+O2��g��=2CO2��g����H2=-Q2 kJ/mol��H2O��g��=H2O��l����H3=-Q3 kJ/mol
��д���״���������ȫȼ������һ����̼����̬ˮ���Ȼ�ѧ��Ӧ����ʽ��______
��3��ijͬѧ���ݼ״�ȼ�յķ�Ӧԭ���������ͼ��ʾ�ĵ��װ�ã�����һ��ʱ������Һ��pH��______����ߡ��������͡��������䡱������ȼ�ϵ�ظ�����Ӧ�����ӷ���ʽΪ��______��

��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ��CO��g��+2H2��g��
 CH3OH��g����H1
CH3OH��g����H1��Ӧ��CO2��g��+3H2��g��
 CH3OH��g��+H2O��g����H2
CH3OH��g��+H2O��g����H2���������Ʊ��״���������Ӧ�У���ӦI���ڷ�ӦII��ԭ��Ϊ______��
���±����������Ƿ�Ӧ���ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ������ֵ��
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
II��ij�¶��£���1mol CO��4molH2����2L���ܱ������У���ַ�Ӧ�ﵽƽ����c��CO��=0.1mol/L����CO��ת����Ϊ______����ʱ���¶�______250�棨�����������������=����
��2����֪�ڳ��³�ѹ�£���2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��l����H1=-Q1kJ/mol
��2CO ��g��+O2��g��=2CO2��g����H2=-Q2 kJ/mol��H2O��g��=H2O��l����H3=-Q3 kJ/mol
��д���״���������ȫȼ������һ����̼����̬ˮ���Ȼ�ѧ��Ӧ����ʽ��______
��3��ijͬѧ���ݼ״�ȼ�յķ�Ӧԭ���������ͼ��ʾ�ĵ��װ�ã�����һ��ʱ������Һ��pH��______����ߡ��������͡��������䡱������ȼ�ϵ�ظ�����Ӧ�����ӷ���ʽΪ��______��


 ��
�� ��
�� ֮��Ĺ�ϵ��
֮��Ĺ�ϵ�� ��Ũ��(mol/L)�ֱ�Ϊ0 8��0.1��0 3��0 15����ʱ
��Ũ��(mol/L)�ֱ�Ϊ0 8��0.1��0 3��0 15����ʱ ��ѡ�>����<����=������
��ѡ�>����<����=������ ��ѡ�>����<����=������
��ѡ�>����<����=������
 CH3OH��g��
CH3OH��g��

 CH3OH(g) ��H1
CH3OH(g) ��H1  CH3OH(g)+H2O(g) ��H2
CH3OH(g)+H2O(g) ��H2 
