题目内容
 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:(1)若B是气态氢化物.C、D是氧化物且会造成光化学烟雾污染.写③反应的化学方程式
(2)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体.写④反应离子方程式
(3)若A是太阳能电池用的光伏材料.C、D为钠盐,两种物质中除钠、氧外的元素均为同一主族,且溶液均显碱性.写出②反应的化学方程式
(4)若A是当今应用最广泛的金属.④反应用到A,②⑤反应均用到同一种非金属单质.C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式
考点:无机物的推断
专题:推断题
分析:(1)若B是气态氢化物.C、D是氧化物且会造成光化学烟雾污染,判断为NO、NO2.B与C在一定条件下反应生成的A是大气主要成分,推断A为N2,B为NH3,依据推断出的物质书写化学方程式;
(2)若D物质具有两性推断D为Al(OH)3,④反应是通入过量的一种引起温室效应的主要气体,说明C为偏铝酸钠NaAlO2,②③反应均要用强碱溶液,判断A为Al,B为AlCl3,依据推断出的物质判断;
(3)若A是太阳能电池用的光伏材料,判断A为Si.C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性,说明盐水解呈碱性,C为Na2SiO3,D为Na2CO3,B为SiO2;
(4)若A是应用最广泛的金属.推断为Fe,④反应用到A,②⑤反应均用到同一种非金属单质.推断为Cl2,C的溶液用于蚀刻印刷铜电路板,判断C为FeCl3,D为FeCl2.
(2)若D物质具有两性推断D为Al(OH)3,④反应是通入过量的一种引起温室效应的主要气体,说明C为偏铝酸钠NaAlO2,②③反应均要用强碱溶液,判断A为Al,B为AlCl3,依据推断出的物质判断;
(3)若A是太阳能电池用的光伏材料,判断A为Si.C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性,说明盐水解呈碱性,C为Na2SiO3,D为Na2CO3,B为SiO2;
(4)若A是应用最广泛的金属.推断为Fe,④反应用到A,②⑤反应均用到同一种非金属单质.推断为Cl2,C的溶液用于蚀刻印刷铜电路板,判断C为FeCl3,D为FeCl2.
解答:
解:(1)若B是气态氢化物.C、D是氧化物且会造成光化学烟雾污染,判断为NO、NO2.B与C在一定条件下反应生成的A是大气主要成分,推断A为N2,B为NH3,③反应的化学方程式为4NH3+5O2
4NO+6H2O,
故答案为:4NH3+5O2
4NO+6H2O;
(2)若D物质具有两性推断D为Al(OH)3,④反应是通入过量的一种引起温室效应的主要气体,说明C为偏铝酸钠NaAlO2,②③反应均要用强碱溶液,判断A为Al,B为AlCl3,单质A为Al,元素在周期表中的位置是第三周期ⅢA族,④反应离子方程式:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-,
故答案为:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-;
(3)若A是太阳能电池用的光伏材料,判断A为Si.C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性,说明盐水解呈碱性,C为Na2SiO3,D为Na2CO3,B为SiO2;反应②的化学方程式为:Si+2NaOH+H2O=Na2SiO3+2H2↑,故答案为:Si+2NaOH+H2O=Na2SiO3+2H2↑;
(4)若A是应用最广泛的金属.推断为Fe,④反应用到A,②⑤反应均用到同一种非金属单质.推断为Cl2,C的溶液用于蚀刻印刷铜电路板,判断C为FeCl3,D为FeCl2,C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式为:Cu+2Fe3+=Cu2++2Fe2+,故答案为:Cu+2Fe3+=Cu2++2Fe2+.
| ||
| △ |
故答案为:4NH3+5O2
| ||
| △ |
(2)若D物质具有两性推断D为Al(OH)3,④反应是通入过量的一种引起温室效应的主要气体,说明C为偏铝酸钠NaAlO2,②③反应均要用强碱溶液,判断A为Al,B为AlCl3,单质A为Al,元素在周期表中的位置是第三周期ⅢA族,④反应离子方程式:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-,
故答案为:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-;
(3)若A是太阳能电池用的光伏材料,判断A为Si.C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性,说明盐水解呈碱性,C为Na2SiO3,D为Na2CO3,B为SiO2;反应②的化学方程式为:Si+2NaOH+H2O=Na2SiO3+2H2↑,故答案为:Si+2NaOH+H2O=Na2SiO3+2H2↑;
(4)若A是应用最广泛的金属.推断为Fe,④反应用到A,②⑤反应均用到同一种非金属单质.推断为Cl2,C的溶液用于蚀刻印刷铜电路板,判断C为FeCl3,D为FeCl2,C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式为:Cu+2Fe3+=Cu2++2Fe2+,故答案为:Cu+2Fe3+=Cu2++2Fe2+.
点评:本题考查了物质转化关系的应用和性质应用,主要考查硫及其化合物性质、氮及其化合物、硅及其化合物、铁及其化合物性质的综合应用,用好条件是解题关键.

练习册系列答案
相关题目
Cu+Cl2
CuCl2的反应类型属于( )
| ||
| A、置换反应 | B、分解反应 |
| C、化合反应 | D、复分解反应 |
下列分子中的中心原子采取sp2杂化的是( )
①C6H6 ②C2H2 ③C2H4 ④C3H8 ⑤CO2 ⑥BeCl2⑦SO3 ⑧BF3.
①C6H6 ②C2H2 ③C2H4 ④C3H8 ⑤CO2 ⑥BeCl2⑦SO3 ⑧BF3.
| A、①②⑥⑦ | B、③⑤⑦⑧ |
| C、①③⑦⑧ | D、③⑤⑥⑦ |
化学工作者从有机反应:RH+C12(气)
RCl(液)+HCl(气)受到启发,提出的在农药和有机合成工业中可获得副产品盐酸的设想已成为现实.已知RCl难溶于水,产物HCl部分溶于RCl液体,指出从上述反应产物混合物中分离得到盐酸的最佳方法是( )
| 光 |
| A、蒸馏法 | B、水洗分液法 |
| C、过滤法 | D、有机溶剂萃取法 |
在同温同压下,10升N2和CO2的混合气体通过足量的Na2O2后,测得气体的体积是6升,原混合气中,CO2的体积分数是( )
| A、20% | B、40% |
| C、60% | D、80% |
化学与生活密切相关,下列说法正确的是( )
| A、回收废旧电池的目的是为了回收废旧电池中的碳棒 |
| B、碘元素是人体必需的微量元素,所以人每天要摄入大量的碘元素 |
| C、“地沟油”虽然对人体有害,但对“地沟油”进行分馏可制得汽油、煤油,达到变废为宝的目的 |
| D、镀锌铁片的镀层受损,还能起到保护铁的作用 |
已知同温度下,三种酸的电离平衡常数的大小关系为Ka(HX)>Ka(HY)>Ka(HZ),则物质的量浓度相同的三种盐NaX、NaY和NaZ溶液pH由大到小的顺序是( )
| A、NaX NaY NaZ |
| B、NaX NaZ NaY |
| C、NaY NaZ NaX |
| D、NaZ NaY NaX |
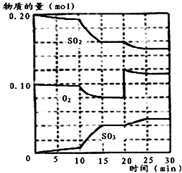 已知一定条件下在1L的密封容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g),△H<0,反应过程中SO2、O2、SO3物质的量变化如图,请根据图示回答下列问题:
已知一定条件下在1L的密封容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g),△H<0,反应过程中SO2、O2、SO3物质的量变化如图,请根据图示回答下列问题: