题目内容
16.下列关于有机物的正确说法是( )| A. | 聚乙烯可发生加成反应 | |
| B. | 石油干馏可得到汽油、煤油等 | |
| C. | 在水溶液里,乙酸分子中的-CH3可以电离出H+ | |
| D. | 在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应 |
分析 A.聚乙烯中不含碳碳双键;
B.石油分馏可得到汽油、煤油等;
C.乙酸分子中含-COOH,电离显酸性;
D.苯与浓硝酸共热生成硝基苯,苯中H被硝基取代.
解答 解:A.聚乙烯中不含碳碳双键,不能发生加成反应,故A错误;
B.石油分馏可得到汽油、煤油等,煤干馏为化学变化,不能得到汽油、煤油,故B错误;
C.乙酸分子中含-COOH,电离显酸性,与乙酸分子中的-CH3无关,故C错误;
D.苯与浓硝酸共热生成硝基苯,苯中H被硝基取代,为取代反应,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意煤和石油的综合应用,题目难度不大.

练习册系列答案
相关题目
13.以下说法与分子间作用力或氢键无关的( )
| A. | 按F、Cl、Br、I的顺序,卤素单质的熔沸点相应升高 | |
| B. | 烷烃随碳原子数目增加,熔沸点相应升高 | |
| C. | 冰的密度低于液态水的密度,冰会浮在水面上 | |
| D. | 按O、S、Se、Te的顺序,氧族元素的气态氢化物稳定性逐渐减弱 |
7.当一个可逆反应进行到正反应速率与逆反应速率相等的时候,就达到了“化学平衡”.对于化学平衡的下列说法中正确的是( )
①化学反应达到化学平衡时,反应物与生成物的浓度(含量)保持不变;
②化学反应达到化学平衡时,整个反应处于停滞状态;
③平衡状态是指可逆反应在给定条件下进行的程度.
①化学反应达到化学平衡时,反应物与生成物的浓度(含量)保持不变;
②化学反应达到化学平衡时,整个反应处于停滞状态;
③平衡状态是指可逆反应在给定条件下进行的程度.
| A. | 只有① | B. | 只有①② | C. | 只有①③ | D. | ①②③ |
4.根据元素周期表和元素周期律分析下面的推断,其中错误的是( )
| A. | H3PO4的酸性比HNO3弱 | B. | 砹(At)的氢化物不稳定 | ||
| C. | 硒(Se)化氢比硫化氢稳定 | D. | 氢氧化钡比氢氧化钙的碱性强 |
11.下列反应的生成物只可能为纯净物的是( )
| A. | CH4与Cl2光照取代反应 | B. | 乙醇与浓硫酸共热 | ||
| C. | 乙炔在空气中的燃烧反应 | D. | 乙烯与氯化氢加成 |
1.铁铬氧化还原液流电池是一种低成本的储能二次电池,电池放电时的结构如下图所示,充放电过程涉及的反应为:Fe3++Cr2+$?_{充电}^{放电}$ Fe2++Cr3+.下列说法一定正确的是( )

| A. | 氧化性:Cr3+>Fe3+ | |
| B. | 电池充电时,b极的电极反应式为Fe3++e-═Fe2+ | |
| C. | a、b电极材料均可以用碳棒或铜片 | |
| D. | 电池放电时,a极c(Cl-)增大 |
8.常温时,ksp(CaC2O4)=2.4×10-9,下列有关0.10mol/L草酸钠溶液的说法,正确的是( )
| A. | 溶液中各离子浓度大小关系c(Na+)>c(C2O42-)>c(OH-)>c(H+)>c(HC2O4-) | |
| B. | 若向溶液中不断加水稀释,水的电离程度增大 | |
| C. | 若用pH计测得溶液的pH=a,则H2C2O4的第二级电离平衡常数Ka2=1013-2a | |
| D. | 若向该溶液中加入等体积CaCl2溶液后能够产生沉淀,则CaCl2溶液的最小浓度应该大于2.4×10-8 mol/L |
5.下列化学用语正确的是( )
| A. | H2O2的电子式: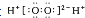 | B. | 次氯酸的结构式:H-O-Cl | ||
| C. | 中子数为10的氧原子:${\;}_8^{10}O$ | D. | 乙酸乙酯的结构简式:C4H8O2 |
6.体积为V ml,密度为ρg•mL-1的溶液,含有式量为M的溶质mg,其物质的量浓度为Cmol•L-1,质量分数为W%,下列关系中正确的是( )
| A. | $C=\frac{W×1000ρ}{M}$ | B. | $m=Vρ•\frac{W}{1000}$ | C. | $W%=\frac{CM}{100ρ}%$ | D. | $C=\frac{1000m}{VM}$ |