题目内容
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9.单质Y和W都可与浓的NaOH溶液反应.下列说法不正确的是( )
| A、离子半径:Z>W>Y |
| B、非金属性最强的元素为W |
| C、Y的最高价氧化物对应的水化物为两性 |
| D、XW2是离子化合物 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W是原子序数依次增大的短周期元素,X原子的最外层电子数与次外层电子数相等,原子只能有2个电子层,最外层电子数为2,则X为Be元素;X与W、Y与Z这两对原子的最外层电子数之和均为9,则W最外层电子数为7,故W为Cl,Z最外层电子数小于7,各元素互不同族,只有两种为金属,故Y只能为Al元素,则Z原子最外层电子数为6,故Z为S元素,结合元素周期律与元素化合物性质解答.
解答:
解:X、Y、Z、W是原子序数依次增大的短周期元素,X原子的最外层电子数与次外层电子数相等,原子只能有2个电子层,最外层电子数为2,则X为Be元素;X与W、Y与Z这两对原子的最外层电子数之和均为9,则W最外层电子数为7,故W为Cl,Z最外层电子数小于7,各元素互不同族,只有两种为金属,故Y只能为Al元素,则Z原子最外层电子数为6,故Z为S元素,
A.S2-、Cl-电子层结构相同,核电荷数越大离子半径减小,Al3+电子层最少,离子半径最小,故离子半径:S2->Cl->Al3+,故A正确;
B.Be、Al为金属,S的非金属性弱于Cl,故Cl元素非金属性最强,故B正确;
C.Y的最高价氧化物对应的水化物是氢氧化铝,属于两性氢氧化物,故C正确;
D.Be与Al处于对角线位置,BeCl2与AlCl3的性质结构相似,BeCl2是共价化合物,故D错误.
故选D.
A.S2-、Cl-电子层结构相同,核电荷数越大离子半径减小,Al3+电子层最少,离子半径最小,故离子半径:S2->Cl->Al3+,故A正确;
B.Be、Al为金属,S的非金属性弱于Cl,故Cl元素非金属性最强,故B正确;
C.Y的最高价氧化物对应的水化物是氢氧化铝,属于两性氢氧化物,故C正确;
D.Be与Al处于对角线位置,BeCl2与AlCl3的性质结构相似,BeCl2是共价化合物,故D错误.
故选D.
点评:本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素周期律的理解掌握,D选项为易错点,可以利用对角线规则解答.

练习册系列答案
相关题目
四种基本化学反应类型①分解反应②化合反应③置换反应④复分解反应,其中不一定属于氧化还原反应的是( )
| A、③ | B、①② |
| C、①②③ | D、①②③④ |
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A、标准状况下,22.4L水含有NA个H2O分子 |
| B、lmol Fe与足量氯气反应时失去的电子数为2NA |
| C、常温常压下,22.4LCl2含有2NA个Cl原子 |
| D、32g由氧气和臭氧组成的混合物中含有氧原子的数目为2NA |
胶体区别于其它分散系最本质的特征是( )
| A、外观澄清、透明 |
| B、分散质粒子能透过半透膜 |
| C、丁达尔现象 |
| D、胶体粒子直径在1~100nm之间 |


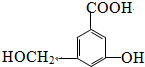
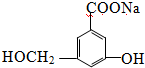
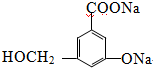
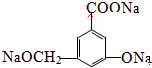 .
.