题目内容
14. 如图是一个实验室制取氯气并以氯气为原料进行特定反应的装置.
如图是一个实验室制取氯气并以氯气为原料进行特定反应的装置.(1)A是氯气发生装置,其中发生的离子方程 式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,Cl2通过C瓶后再进入D.D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl.则该反应的化学方程式为2Cl2+2H2O+C$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4HCl.
(3)该装置图尚未画完,请在E处补充完整,并注明试剂名称.
(4)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,则B的作用是储存Cl2.
(5)若实验中使用12mol•L-1的浓盐酸10mL与足量的MnO2反应,则生成的Cl2的物质的量总是小于0.03mol,试分析可能存在的原因是随着反应的进行,盐酸变稀,稀HCl与MnO2不反应;HCl的挥发.
分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(2)D中的反应是氯气和碳、水反应生成两种气体净化原子守恒和气体体积比写出化学方程式;
(3)D生成的氯化氢为空气污染气体,不能直接排放,氯化氢易溶于水,可以用水吸收,注意防止倒吸的发生;
(4)根据B装置内气体的压强变化分析液面变化;
(5)依据浓盐酸的挥发性及浓盐酸随反应进行,浓盐酸反应一定程度变为稀盐酸不再和二氧化锰反应生成氯气分析;
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)Cl2通过C瓶后再进入D,D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,依据原子守恒和气体体积比可知生成气体为氯化氢和二氧化碳,反应的化学方程式为:2Cl2+2H2O(g)+C═4HCl+CO2;
故答案为:2Cl2+2H2O+C$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4HCl;
(3)D生成的氯化氢为空气污染气体,不能直接排放,氯化氢易溶于水,可以用水吸收,注意防止倒吸的发生,装置图: ,盛放试剂为水;
,盛放试剂为水;
故答案为: ;水;
;水;
(4)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,气体通过导管进入B装置,导致B装置中气体的压强增大,大于大气压,迫使瓶中液面下降,长颈漏斗内液面上升,饱和食盐水能抑制氯气的溶解,所以B装置的作用是贮存少量Cl2;
故答案为:储存Cl2;
(5)浓盐酸具有挥发性,且浓盐酸随反应进行,浓盐酸反应一定程度变为稀盐酸不再和二氧化锰反应生成氯气;
故答案为:随着反应的进行,盐酸变稀,稀HCl与MnO2不反应;HCl的挥发;
点评 本题考查了实验制备氯气的装置分析,性质验证和设计,物质的性质,发生反应的实质判断,实验注意问题,题目难度中等.

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案| A. | 由2H和18O所组成的水22g,其中所含的中子数为11 NA | |
| B. | 分子数为NA的N2、CO混合气体体积为22.4 L,质量为28 g | |
| C. | 标准状况下,22.4LNO和11.2L O2混合后气体的原子总数为3NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA |
| A. | 浓硝酸使紫色石蕊试液先变红后褪色--酸性和强氧化性 | |
| B. | 不能用稀硝酸与锌反应制氢气--强氧化性 | |
| C. | 要用棕色瓶盛装浓硝酸--不稳定性 | |
| D. | 能使滴有酚酞的氢氧化钠溶液红色褪去--强氧化性 |
| 操 作 | 现 象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
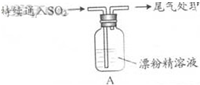 | i.液面上方出现白雾; ii.稍后,出现浑浊,溶液变为黄绿色; iii.稍后,产生大量白色沉淀,黄绿色褪去 |
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是碱性、漂白性.
(3)向水中持续通入SO2,未观察到白雾.推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀.
①实验a目的是检验白雾中是否含有Cl2,排除Cl2干扰.
②由实验a、b不能判断白雾中含有HC1,理由是白雾中含有SO2,SO2可以使酸化的AgNO3溶液产生白色沉淀
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应.通过进一步实验确认了这种可能性,其实验方案是向漂粉精溶液中逐滴滴入硫酸,观察溶液颜色是否变为黄绿色
(5)将A瓶中混合物过滤、洗涤,得到沉淀X.
①向沉淀X中加入稀HC1,无明显变化.取上层清液,加入BaC12溶液,产生白色沉淀.则沉淀X中含有的物质是CaSO4.
②用离子方程式解释现象iii中黄绿色褪去的原因:Cl2+SO2+2H2O=4H++2Cl-+SO42-.
| A. | 2.0g H218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,60g丙醇中存在的共价键总数为10NA | |
| C. | 1 molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| D. | 标准状况下,2.24L三氯甲烷中含有C-Cl键数目为0.3NA |
 ,其中含有的化学键类型为离子键和共价键.
,其中含有的化学键类型为离子键和共价键.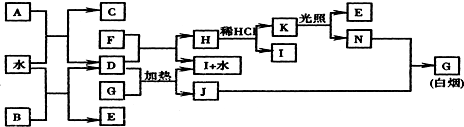
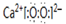 ;K的结构式是H-O-Cl.
;K的结构式是H-O-Cl.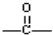
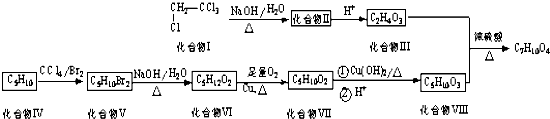
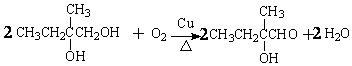 .
.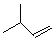 ,该六元环酯(C7H10O4)的结构简式为
,该六元环酯(C7H10O4)的结构简式为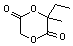 .
.