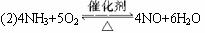题目内容
取KClO3和MnO2的混合物16.60g加热至恒重,将反应后的固体加15g水充分溶解,剩余固体6.55g (25℃),再加5g水充分溶解,仍剩余固体4.80g(25℃).
(1)若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为______g(保留2位小数).
(2)若剩余的4.80g固体是MnO2和KC1的混合物,则25℃时KC1的溶解度为______.
原混合物中KClO3的质量为______g;所得KC1溶液的密度为l.72g/cm3,则溶液物质的量浓度为______mol/L(保留2位小数).
解:(1)若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为16.60g-4.80g=11.80g,
故答案为:11.80;
(2)若剩余的4.80g固体是MnO2和KC1的混合物,则5g水溶解的氯化钾为6.55g-4.8g=1.75g,故氯化钾的溶解度为1.75g× =35g;
=35g;
15g水溶解KCl的质量为1.75g× =5.25g,混合物加热后剩余固体的质量为6.55g+5.25g=11.8g,加热固体生成的氧气质量为16.6g-11.8g=4.8g,则:
=5.25g,混合物加热后剩余固体的质量为6.55g+5.25g=11.8g,加热固体生成的氧气质量为16.6g-11.8g=4.8g,则:
2KClO3 2KCl+3O2↑
2KCl+3O2↑
245g 96g
m(KClO3) 4.8g
所以m(KClO3)= =12.25g,
=12.25g,
所得的KCl溶液为饱和溶液,KCl的质量分数为 =
= ,KC1溶液的密度为l.72g/cm3,则氯化钾溶液的物质的量浓度为
,KC1溶液的密度为l.72g/cm3,则氯化钾溶液的物质的量浓度为 mol/L=5.99mol/L,
mol/L=5.99mol/L,
故答案为:35g;12.25;5.99.
分析:(1)若剩余的4.80g固体全是MnO2,则原混合物的质量减去二氧化锰的质量为氯酸钾的质量;
(2)若剩余的4.80g固体是MnO2和KC1的混合物,则5g水溶解的氯化钾为6.55g-4.8g=1.75g,据此解答氯化钾的溶解度;
根据5g水溶解的氯化钾计算15g水溶解KCl的质量,进而计算混合物加热后剩余固体的质量,利用差量法计算生成的氧气的质量,根据方程式计算原混合物混合物中KClO3的质量;
所得的KCl溶液为饱和溶液,根据溶解度计算KCl的质量分数,利用c=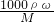 计算氯化钾溶液的物质的量浓度.
计算氯化钾溶液的物质的量浓度.
点评:本题考查物质的量浓度、溶解度有关计算,难度中等,(2)中计算溶解度是解题的关键,注意掌握物质的量浓度与质量分数的关系.
故答案为:11.80;
(2)若剩余的4.80g固体是MnO2和KC1的混合物,则5g水溶解的氯化钾为6.55g-4.8g=1.75g,故氯化钾的溶解度为1.75g×
 =35g;
=35g;15g水溶解KCl的质量为1.75g×
 =5.25g,混合物加热后剩余固体的质量为6.55g+5.25g=11.8g,加热固体生成的氧气质量为16.6g-11.8g=4.8g,则:
=5.25g,混合物加热后剩余固体的质量为6.55g+5.25g=11.8g,加热固体生成的氧气质量为16.6g-11.8g=4.8g,则:2KClO3
 2KCl+3O2↑
2KCl+3O2↑245g 96g
m(KClO3) 4.8g
所以m(KClO3)=
 =12.25g,
=12.25g,所得的KCl溶液为饱和溶液,KCl的质量分数为
 =
= ,KC1溶液的密度为l.72g/cm3,则氯化钾溶液的物质的量浓度为
,KC1溶液的密度为l.72g/cm3,则氯化钾溶液的物质的量浓度为 mol/L=5.99mol/L,
mol/L=5.99mol/L,故答案为:35g;12.25;5.99.
分析:(1)若剩余的4.80g固体全是MnO2,则原混合物的质量减去二氧化锰的质量为氯酸钾的质量;
(2)若剩余的4.80g固体是MnO2和KC1的混合物,则5g水溶解的氯化钾为6.55g-4.8g=1.75g,据此解答氯化钾的溶解度;
根据5g水溶解的氯化钾计算15g水溶解KCl的质量,进而计算混合物加热后剩余固体的质量,利用差量法计算生成的氧气的质量,根据方程式计算原混合物混合物中KClO3的质量;
所得的KCl溶液为饱和溶液,根据溶解度计算KCl的质量分数,利用c=
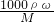 计算氯化钾溶液的物质的量浓度.
计算氯化钾溶液的物质的量浓度.点评:本题考查物质的量浓度、溶解度有关计算,难度中等,(2)中计算溶解度是解题的关键,注意掌握物质的量浓度与质量分数的关系.

练习册系列答案
相关题目