题目内容
有88g D218O 和36g H2O,试回答:
(1)两者所含的质子数之比为
(2)两者所含的中子数之比为
(3)若将它们分别与足量的金属钠反应,两者产生的气体的质量之比为 .
(1)两者所含的质子数之比为
(2)两者所含的中子数之比为
(3)若将它们分别与足量的金属钠反应,两者产生的气体的质量之比为
考点:质量数与质子数、中子数之间的相互关系
专题:原子组成与结构专题
分析:根据n=
,以及1个D218O中含有10个质子,12个中子,1个H2O中含有10个质子,8个中子计算并求出比值.
根据关系式 2D218O~D2↑或2H2O~H2↑计算;
| m |
| M |
根据关系式 2D218O~D2↑或2H2O~H2↑计算;
解答:
解:88g D218O的物质的量为
=4mol,36g H2O的物质的量为
=2mol,
(1)1个D218O中含有10个质子,1个H2O中含有10个质子,所以88g D218O 和36g H2O中所含的质子数之比为2:1;
故答案为:2:1;
(2)1个D218O中含有12个中子,1个H2O中含有8个中子,所以88g D218O 和36g H2O中所含的中子数之比为3:1;
故答案为:3:1;
(3)由关系式 2D218O~D2↑或2H2O~H2↑可知88g D218O 和36g H2O,与足量的金属钠反应,两者产生的气体的物质的量之比为2:1,质子之比为(2×4):(1×2)=4:1,
故答案为:4:1.
| 88g |
| 22g/mol |
| 36g |
| 18g/mol |
(1)1个D218O中含有10个质子,1个H2O中含有10个质子,所以88g D218O 和36g H2O中所含的质子数之比为2:1;
故答案为:2:1;
(2)1个D218O中含有12个中子,1个H2O中含有8个中子,所以88g D218O 和36g H2O中所含的中子数之比为3:1;
故答案为:3:1;
(3)由关系式 2D218O~D2↑或2H2O~H2↑可知88g D218O 和36g H2O,与足量的金属钠反应,两者产生的气体的物质的量之比为2:1,质子之比为(2×4):(1×2)=4:1,
故答案为:4:1.
点评:本题主要考查了物质的量以及分子中粒子数目之间的关系,难度不大,注意D218O的相对分子质量.

练习册系列答案
相关题目
下列有关化学用语表示正确的是( )
| A、乙醇的结构简式C2H6O | ||
B、氨基的电子式 | ||
C、镁离子的结构示意图 | ||
D、中子数为79、质子数为55 的铯(Cs)原子
|
对下列实验的描述正确的是( )
A、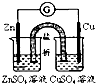 图中所示的实验:根据检流计(G)中指针偏转的方向比较Zn、Cu的金属活泼性(检流计的偏转方向为电子流的流动方向) |
B、 图中所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀 |
C、 图中所示的实验:根据温度计读数的变化用浓硫酸和NaOH反应测定中和热 |
D、 图中所示的实验:根据两试管中溶液颜色的变化(热水中变蓝、冰水中变粉)判断Co(H2O)62+(蓝色)+4Cl-?CoCl42-(粉红色)+6H2O是放热反应 |

 已知A是一种不溶于水的固体非金属氧化物,根据下列转化关系回答下列各题:
已知A是一种不溶于水的固体非金属氧化物,根据下列转化关系回答下列各题: 中的手性碳原子
中的手性碳原子

 △H=
△H=