题目内容
13.下列运用与碳酸钠或碳酸氢钠能发生水解的事实无关的是( )| A. | 实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞 | |
| B. | 泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将其混合就可产生大量二氧化碳的泡沫 | |
| C. | 将稀盐酸逐滴加入到Na2CO3溶液中,开始无二氧化碳放出 | |
| D. | 可用碳酸钠与醋酸制取少量二氧化碳 |
分析 A.碳酸钠和碳酸氢钠都为强碱弱酸盐,水解呈碱性,碱性溶液不能用磨口玻璃塞盛放;
B.泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,混合后发生双水解反应;
C.盐酸逐滴加到碳酸钠溶液,先发生反应生成碳酸氢钠,再发生反应生成二氧化碳.
D.醋酸的酸性强于碳酸,依据强酸制备弱酸原理解答.
解答 解:A.碳酸钠水解呈碱性,可与二氧化硅反应生成硅酸钠而导致玻璃瓶打不开,与盐类水解有关,故A不选;
B.泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,混合后铝离子和碳酸氢根离子发生双水解生成二氧化碳和氢氧化铝沉淀,与盐类水解有关,故B不选;
C.盐酸逐滴加到碳酸钠溶液,先发生反应生成碳酸氢钠,再发生反应生成二氧化碳,与盐类的水解无关,故C选;
D.醋酸的酸性强于碳酸,可用碳酸钠与醋酸制取少量二氧化碳,与盐类水解无关,故D选;
故选:CD.
点评 本题考查了盐类水解,侧重于盐的水解原理在生活中的应用的考查,熟悉物质的性质是解题关键,注意盐类水解规律,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.白酒、食醋、蔗糖、淀粉等均为家庭厨房中常用的物质,利用这些物质能完成下列实验中的( )
①检验自来水中是否含氯离子 ②鉴别食盐和小苏打 ③确定蛋壳是否含碳酸钙 ④检验食盐中是否加碘.
①检验自来水中是否含氯离子 ②鉴别食盐和小苏打 ③确定蛋壳是否含碳酸钙 ④检验食盐中是否加碘.
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
1.下列装置能构成原电池的是 ( )
| A. | 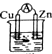 乙醇 | B. |  稀H2SO4 | C. |  稀HCl | D. |  稀H2SO4 |
8. 由可逆反应测绘出图象如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是( )
由可逆反应测绘出图象如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是( )
 由可逆反应测绘出图象如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是( )
由可逆反应测绘出图象如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是( )| A. | 反应物中一定有气体 | B. | 生成物中不一定有气体 | ||
| C. | 正反应一定是放热反应 | D. | 正反应一定是吸热反应 |
18.将纯铁片和纯钢片按如图所示插入同浓度的稀硫酸中一段时间,下列说法正确的是( )

| A. | 甲装置中电能转化为化学能 | |
| B. | 两个装置中铜片表面均有气泡产生 | |
| C. | 甲装置中铜片表面发生了还原反应 | |
| D. | 甲装置中负极上发生的电极反应为Fe-3e-═Fe3+ |
5.元素周期表中ⅣA族的元素又称为碳族元素.包含碳、硅、锗(Ge)、锡(Sn)和铅(Pb).同一主族元素的结构和性质具有相似性和递变性.
(1)有机物均含碳元素,甲烷为最简单的有机物.检验甲烷完全燃烧后的产物需用的试剂为澄清石灰水、无水硫酸铜(填试剂名称).
(2)硅为无机非金属材料的主角,写出二氧化硅的一种工业用途制光导纤维.
(3)亚锡离子(Sn2+)与Fe3+反应生成Sn4+,反应的离子方程式为Sn2++2Fe3+=Sn4++2Fe2+
(4)PbO2为褐色粉末,随温度升高会逐步分解:PbO2→PbxOx→PbO(PbxOy表示不同温度下铅的氧化物的化学式).
己知,23.90gPbO2在不同温度下残留固体(均为纯净物)的质量见表
分别求出T2℃和T3℃时的PbxOy,并写出由T2℃升高到T3℃过程中反应的化学方积式Pb5O7$\frac{\underline{\;加热\;}}{\;}$5PbO+O2↑.(写出必要的计算过程,否则不得分).
(1)有机物均含碳元素,甲烷为最简单的有机物.检验甲烷完全燃烧后的产物需用的试剂为澄清石灰水、无水硫酸铜(填试剂名称).
(2)硅为无机非金属材料的主角,写出二氧化硅的一种工业用途制光导纤维.
(3)亚锡离子(Sn2+)与Fe3+反应生成Sn4+,反应的离子方程式为Sn2++2Fe3+=Sn4++2Fe2+
(4)PbO2为褐色粉末,随温度升高会逐步分解:PbO2→PbxOx→PbO(PbxOy表示不同温度下铅的氧化物的化学式).
己知,23.90gPbO2在不同温度下残留固体(均为纯净物)的质量见表
| 温度/℃ | T1 | T2 | T3 | T4 |
| 残留固体质量/g | 23.90 | 23.10 | 22.94 | 22.30 |
2. 为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验的到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )
为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验的到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )
 为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验的到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )
为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验的到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )| A. | 在恒温恒容条件下,向已达到平衡的体系中加入少量Z,平衡正向移动,Z的含量增大 | |
| B. | 升高温度,正、逆反应速率都增大,平衡常数增大 | |
| C. | △H<0 m+n>c | |
| D. | △H>0 m+n<c |
3.下列描述对象所含分子数由多到少的排列顺序是( )
①3g H2
②所含电子的物质的量为4mol的H2
③45g H2O
④常温下,16g O2与14g N2的混合气体
⑤含原子总数约为1.204×1024的NH3.
①3g H2
②所含电子的物质的量为4mol的H2
③45g H2O
④常温下,16g O2与14g N2的混合气体
⑤含原子总数约为1.204×1024的NH3.
| A. | ①②③④⑤ | B. | ③②①④⑤ | C. | ③②⑤①④ | D. | ②③①④⑤ |
