题目内容
1.在①Al ②Al(OH)3③H2SO4④NaHCO3⑤Na2CO3中,与盐酸和氢氧化钠溶液均可反应的是( )| A. | ①②④ | B. | ①③⑤ | C. | ①②③④ | D. | ②④⑤ |
分析 根据物质间的反应进行判断,中学常见的既能与酸反应又能与碱反应的物质主要有:
①两性物质:Al2O3、ZnO、Al(OH)3、Zn(OH)2、氨基酸、蛋白质等;
②多元弱酸的酸式盐:NaHCO3、KHS、KHSO3、NaH2PO4等;
③弱酸的铵盐及其酸式盐:(NH4)2S、NH4HS、(NH4)2CO3、NH4HCO3、CH3COONH4等;
④某些具有两性的金属:Zn、Al等;
⑤某些非金属:Si、S等;
⑥其它一些物质.如:a、某些盐类物质既与酸反应,又与碱反应;
b、个别酸性氧化物SiO2;
c、具有还原性的无氧酸:H2S、HI等与氧化性酸反应、与碱反应;
d、具有氧化性酸:浓H2SO4、HNO3等与还原性酸反应、与碱反应.以此解答本题.
解答 解:①金属铝与盐酸反应生成铝盐(Al3+)和氢气,与氢氧化钠反应生成偏铝酸盐(AlO2-)和氢气,故①正确;
②Al(OH)3属于两性氢氧化物,既能与酸反应,生成铝盐(Al3+),又能与碱反应生成偏铝酸盐(AlO2-),故②正确;
③H2SO 与氢氧化钠反应,不盐酸反应,故③错误;
④NaHCO3属于弱酸弱碱盐,既能与盐酸反应,生成CO2气体,又能与氢氧化钠反应,生成盐,故④正确;
⑤Na2CO3与盐酸反应生成二氧化碳,不与氢氧化钠反应,故⑤错误;
故选A.
点评 本题考查元素化合物的性质,题目难度不大,旨在考查学生对知识的理解识记与知识归纳,注意基础知识的积累.

练习册系列答案
相关题目
11.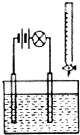 对电解质溶液的导电性进行实验,其装置如图所示.若向某一电解质溶液中逐滴加入另一溶液时,灯泡由亮变暗至熄灭,后又逐渐变亮的是( )
对电解质溶液的导电性进行实验,其装置如图所示.若向某一电解质溶液中逐滴加入另一溶液时,灯泡由亮变暗至熄灭,后又逐渐变亮的是( )
 对电解质溶液的导电性进行实验,其装置如图所示.若向某一电解质溶液中逐滴加入另一溶液时,灯泡由亮变暗至熄灭,后又逐渐变亮的是( )
对电解质溶液的导电性进行实验,其装置如图所示.若向某一电解质溶液中逐滴加入另一溶液时,灯泡由亮变暗至熄灭,后又逐渐变亮的是( )| A. | 盐酸中逐滴加入NaCl溶液 | B. | 氢硫酸中逐滴加入氢氧化钠溶液 | ||
| C. | 醋酸中逐滴加氨水 | D. | 硫酸中逐滴加入氢氧化钡溶液 |
12. 在一个密闭容器中用一可移动板隔开,左边充有氮气,右边充入H2、O2,在室温下用电火花点燃混合气体,反应后仍冷却至室温,隔板终止于容器中点,则原混合气体中H2、O2的体积比是( )
在一个密闭容器中用一可移动板隔开,左边充有氮气,右边充入H2、O2,在室温下用电火花点燃混合气体,反应后仍冷却至室温,隔板终止于容器中点,则原混合气体中H2、O2的体积比是( )
 在一个密闭容器中用一可移动板隔开,左边充有氮气,右边充入H2、O2,在室温下用电火花点燃混合气体,反应后仍冷却至室温,隔板终止于容器中点,则原混合气体中H2、O2的体积比是( )
在一个密闭容器中用一可移动板隔开,左边充有氮气,右边充入H2、O2,在室温下用电火花点燃混合气体,反应后仍冷却至室温,隔板终止于容器中点,则原混合气体中H2、O2的体积比是( )| A. | 2:7 | B. | 6:3 | C. | 4:5 | D. | 8:1 |
9.下列物质中,含有非极性键的共价化合物是( )
| A. | CH4 | B. | H2O2 | C. | KCl | D. | O2 |
13.设NA代表阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 0.1NA个H2分子的质量为0.2g | |
| B. | 常温常压下,11.2L氯气所含的原子数目为NA | |
| C. | 32g氧气的体积为22.4L | |
| D. | 体积相同的H2和O2含有相同的分子数 |
10.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 2.4g金属镁变成镁离子时失去的电子数目为0.1NA | |
| B. | 2g氢气所含原子数目为NA | |
| C. | 1mol Al3+含有核外电子数为3NA | |
| D. | 17g氨气所含电子数目为10NA |
17.下列说法不正确的是( )
| A. | 使用溴水或酸性KMnO4溶液都可鉴别乙烯和甲烷 | |
| B. | 在加热或加入重金属盐的情况下,蛋白质都可发生变性 | |
| C. | 液化石油气和天然气的主要成分都是甲烷 | |
| D. | 淀粉水解的最终产物是葡萄糖 |