题目内容
 已知固体A的焰色反应呈黄色,D、G常温下呈气态,化合物E为淡黄色固体粉末,A、B、C、D、E、F、G有如图转化关系:
已知固体A的焰色反应呈黄色,D、G常温下呈气态,化合物E为淡黄色固体粉末,A、B、C、D、E、F、G有如图转化关系:回答下列问题:
(1)写出下列物质的化学式:
A
NaHCO3
NaHCO3
,ENa2O2
Na2O2
.(2)写出下列反应的化学方程式,是离子反应的写离子方程式.
反应①:
2NaHCO3
Na2CO3+CO2↑+H2O
| ||
2NaHCO3
Na2CO3+CO2↑+H2O
,A的溶液与F的溶液混合:
| ||
HCO3-+OH-=CO32-+H2O
HCO3-+OH-=CO32-+H2O
.(3)经反应③产生的G在标准状况下为1.12L,则该反应中转移的电子的物质的量为
0.1
0.1
mol,此反应中消耗的E的质量为7.8
7.8
g.分析:固体A的焰色反应呈黄色,说明其中含有钠元素,淡黄色固体粉末中能和二氧化碳反应的只有过氧化钠以此为解题的关键进行解答.
解答:解:(1)根据图示可知A是含有钠元素的化合物,受热分解生成三种产物,所以A是碳酸氢钠,气体D是二氧化碳,化合物E为淡黄色固体粉末,能和二氧化碳反应,所以E是过氧化钠,过氧化钠和二氧化碳反应生成气体氧气和碳酸钠,所以G是氧气,B是碳酸钠,所以C是水,过氧化钠和水反应生成氢氧化钠和氧气,所以F是氢氧化钠,故答案为:NaHCO3;Na2O2;
(2)碳酸氢钠固体分解的方程式为:2NaHCO3
Na2CO3+CO2↑+H2O,碳酸氢钠和氢氧化钠混合,反应实质是HCO3-+OH-=CO32-+H2O,
故答案为:2NaHCO3
Na2CO3+CO2↑+H2O;HCO3-+OH-=CO32-+H2O;
(3)反应③的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,化合价发生变化的元素只有氧元素,Na2O2中氧元素化合价是-1价,产物中氧元素化合价为0价和-2价,Na2O2氧化剂又是还原剂,根据方程式并结合氧元素化合价可知每有2mol过氧化钠反应,则转移电子2mol,同时生成氧气1mol,当产生的氧气在标准状况下为1.12L(即0.05mol)时,则该反应中转移的电子的物质的量为0.1mol,消耗过氧化钠0.1mol,即7.8g,故答案为:0.1;7.8.
(2)碳酸氢钠固体分解的方程式为:2NaHCO3
| ||
故答案为:2NaHCO3
| ||
(3)反应③的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,化合价发生变化的元素只有氧元素,Na2O2中氧元素化合价是-1价,产物中氧元素化合价为0价和-2价,Na2O2氧化剂又是还原剂,根据方程式并结合氧元素化合价可知每有2mol过氧化钠反应,则转移电子2mol,同时生成氧气1mol,当产生的氧气在标准状况下为1.12L(即0.05mol)时,则该反应中转移的电子的物质的量为0.1mol,消耗过氧化钠0.1mol,即7.8g,故答案为:0.1;7.8.
点评:本题主要考查了根据物质的性质和实验现象判断物质的组成等方面的内容.本题型推断并不是主要问题,关键是框图所涉及的化学反应学生必须熟悉,才能使答案更准确.

练习册系列答案
相关题目
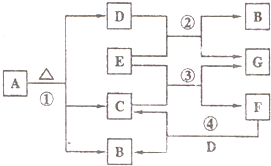 已知固体A的焰色反应呈黄色、D、G在常温下呈气态,化合物E为淡黄色固体粉末,A、B、C、D、E、F、G有如图转化关系.
已知固体A的焰色反应呈黄色、D、G在常温下呈气态,化合物E为淡黄色固体粉末,A、B、C、D、E、F、G有如图转化关系.  已知固体A的焰色反应呈黄色,D、G常温下呈气态,化合物E为淡黄色固体粉末,A、B、C、D、E、F、G有如图转化关系:
已知固体A的焰色反应呈黄色,D、G常温下呈气态,化合物E为淡黄色固体粉末,A、B、C、D、E、F、G有如图转化关系:
