题目内容
9.向一定量Fe3O4和Fe的混合物中加入50mL2mol•L-1H2SO4溶液,恰好使混合物完全溶解,放出448mL(标准状况下)的气体.向所得溶液中加入KSCN溶液,无红色出现.则用足量的CO在高温下与相同质量的此混合物充分反应,能得到铁的质量为( )| A. | 2.8g | B. | 5.6g | C. | 11.2g | D. | 22.4g |
分析 Fe3O4和Fe的混合物中加入硫酸恰好使混合物完全溶解,生成了铁的硫酸盐,因加入KSCN 溶液,无血红色出现,说明只生成硫酸亚铁,根据;硫酸根守恒则:n(FeSO4)=n(H2SO4),足量CO与相同质量的Fe3O4和Fe,根据Fe元素守恒n(Fe)=n(FeSO4),再根据m=nM计算得到Fe元素质量.
解答 解:Fe3O4和Fe的混合物中加入硫酸恰好使混合物完全溶解,生成了铁的硫酸盐,因加入KSCN 溶液,无血红色出现,说明只生成硫酸亚铁,根据;硫酸根守恒则:n(FeSO4)=n(H2SO4)=2mol/L×0.05L=0.1mol,足量CO与相同质量的Fe3O4和Fe,根据Fe元素守恒n(Fe)=n(FeSO4)=0.1mol,故m(Fe)=0.1mol×56g/mol=5.6g,
故选B.
点评 本题考查混合物计算,题目难度中等,注意利用原子守恒简化计算.

练习册系列答案
相关题目
13.已知H2的燃烧热△H为-285.8kJ•mol-1,CO的燃烧热△H为-282.8kJ•mol-1.现有H2和CO的混合气体,完全燃烧时放出113.72kJ热量,同时生成3.6g液态水.下列推断正确的是( )
| A. | 该混合气体体积为8.96L | |
| B. | 该混合气体中CO、H2的物质的量之比为1:1 | |
| C. | 表示CO燃烧热的热化学方程式为2CO(g)+O2(g)═2CO2(g)△H=-565.6kJ•mol-1 | |
| D. | 氢气燃烧的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8kJ•mol-1 |
20.药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:

下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A. | 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 | |
| B. | 可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3 溶液反应 | |
| D. | 对乙酰氨基酚分子中核磁共振氢谱出现五组峰,且峰面积之比为3:1:2:2:1 |
4.下列有关环境、健康、发展的叙述中,不正确的是( )
| A. | 可吸入颗粒(例如硅酸盐粉尘)形成气溶胶,对人类健康危害极大 | |
| B. | 开发利用绿色能源(例如太阳能)替代化石燃料是人类可持续发展的必由之路 | |
| C. | 装修材料中的苯主要来自胶、漆等,是强致癌物 | |
| D. | 氟氯烃含量是空气质量报告的主要项目之一 |
1.下列说法中错误的是( )
| A. | 煤中含有苯及苯的同系物,可以通过干馏得到 | |
| B. | 煤是由有机物和无机物组成的复杂的混合物 | |
| C. | 含C18以上的烷烃经过催化裂化可以得到汽油 | |
| D. | 石油含有C5~C11的烷烃,可通过分馏得到汽油 |
19.研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O+2AgCl下列“水”电池在海水中放电时的有关说法正确的是( )
| A. | AgCl是还原产物 | |
| B. | 正极反应式:Ag+Cl--e-=AgCl | |
| C. | 每生成1molNa2Mn5O10转移2 mol电子 | |
| D. | Na+不断向“水”电池的负极移动 |
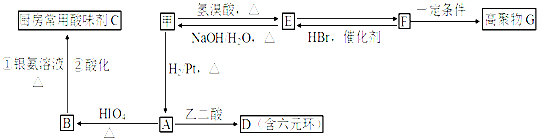
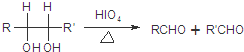
 .
. .
.
 ,PBS的结构简式是
,PBS的结构简式是 .
.


 (R1、R2、R3为烃基或氢原子)
(R1、R2、R3为烃基或氢原子) .
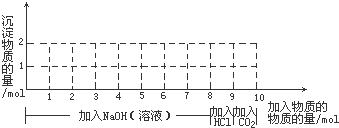
. .
.