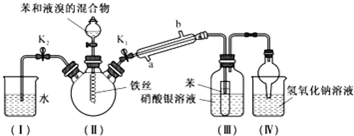
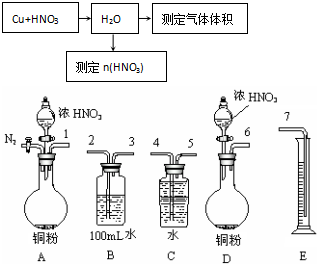
题目内容
5.请回答下列问题(1)写出水蒸气与铁在高温下的反应:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2产物中+2价的Fe和+3价Fe的物质量之比:1:2.
(2)写出如图混合物KNO3、KOH、Fe2O3在加热共融制得高铁酸鉀的化学方程式 并配平:
1Fe2O3+3KNO3+4KOH-2K2FeO4+3KNO2+2H2O
(3)写出铅蓄电池充电时阳极的电池反应式PbSO4+2H2O-2e-=PbO2+SO42-+4H+.
分析 (1)铁与水蒸气在高温条件下反应生成四氧化三铁和氢气;Fe3O4粉可看做FeO•Fe2O3;
(2)KNO3、KOH、Fe2O3在加热共融,反应生成高铁酸钾、亚硝酸钾和水,根据得失电子相等、质量守恒配平;
(3)在充电时是电解池的工作原理,阳极上发生失电子的氧化反应,二价铅失去电子生成氧化铅.
解答 解:(1)铁与水蒸气在高温条件下反应生成四氧化三铁和氢气,反应方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
Fe3O4粉可看做FeO•Fe2O3,FeO中铁为+2价,Fe2O3中铁为+3价,所以产物中+2价的Fe和+3价Fe的物质量之比:1:2;
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;1:2;
(2)KNO3、KOH、Fe2O3在加热共融,反应生成高铁酸钾、亚硝酸钾和水,K2FeO4中铁元素化合价为+6,则亚铁离子从+3价变为+6价,化合价升高3价,化合价至少升高3×2=6价;KNO3中N元素从+5降为KNO2中的+3价,化合价降低2价,则化合价最小公倍数为6,所以氧化铁的系数为1,KNO3的系数为3,然后根据质量守恒定律配平,配平后的方程式为:Fe2O3+3KNO3+4KOH=K2FeO4+3KNO2+2H2O,
故答案为:1 Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O;
(3)充电时,阳极PbSO4发生氧化反应,电极反应为:PbSO4+2H2O-2e-=PbO2+4H++SO42-;
故答案为:PbSO4+2H2O-2e-=PbO2+SO42-+4H+.
点评 本题考查了氧化还原反应,主要涉及氧化还原反应方程式书写,准确分析反应中元素化合价变化及生成物判断是解题关键,题目难度中等.

 金钥匙试卷系列答案
金钥匙试卷系列答案(1)取1g该有机物,加热到蒸汽,测得气体的体积为0.4869L(气体体积已换算成标准状况),由此确定该有机物的摩尔质量为46g/mol.
(2)另取一定量该有机物,在足量的氧气中充分燃烧,只生成二氧化碳和水蒸汽,由此可以初步得到的结论是C
A.该有机物一定含有碳、氢、氧元素
B 该有机物一定是烃类化合物
C 该有机物一定含有碳和氢元素
D 该有机物一定含有氧元素
(3)再取2.3g该有机物完全燃烧,将燃烧后的产物先通过浓硫酸,然后通入足量的澄清石灰水.浓硫酸增重2.7g,石灰水中产生10g沉淀,则可以确定该有机物的分子式是C2H6O.
该有机物可能的结构简式为CH3CH2OH、CH3OCH3.
(4)为进一步确定该有机物的分子结构,某学生小组进行下列实验:
取一定量该有机物与钠完全反应,放出氢气的体积如下(换算成标准状况):
| 有机物(g) | 氢气(L) |
| 0.575 | 0.14 |
| 1.15 | 0.28 |
| 2.3 | 0.56 |
(5)将一根粗铜丝绕成螺旋状加热,观察到铜丝,迅速伸入盛有该有机物的试管里,反复多次.观察到铜丝,试管中闻到气味.
| A. | 1molOH-离子中含电子数目为10NA | |
| B. | 0.5L 0.2mol•L-1的NaCl溶液中含有的Na+数是0.1NA | |
| C. | 分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量约为28 g | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
| A. | 1molNa2O2固体中含阴离子个数为2NA | |
| B. | 1molSiO2中含Si-O的数目为2NA | |
| C. | 标准状况下,22.4L乙炔中含π键数为2NA | |
| D. | 1molNaHCO3晶体中阳离子数为2NA |
| A. | 分子数之比1:1 | B. | 密度之比4:11 | C. | 密度之比11:16 | D. | 体积之比11:16 |
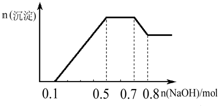
| A. | 溶液中的阳离子只有H+、Mg2+、Al3+ | |
| B. | 溶液中一定不含CO32-,一定含有SO42-和NO3- | |
| C. | 溶液中n(NH4+)=0.2 mol | |
| D. | 三种离子的物质的量之比n(H+):n(Al3+):n(Mg2+)=1:1:1 |
 .
. ,A与等物质的量的H2完全加成后,得到烃C,用系统命名法给C命名2-甲基丁烷.
,A与等物质的量的H2完全加成后,得到烃C,用系统命名法给C命名2-甲基丁烷.