题目内容
2. 氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:①Al2O3在碳的还原作用下生成铝的气态低价氧化物X(X中Al与O的质量比为6.75:2);②在碳存在下,X与N2反应生成AlN.请回答:
氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:①Al2O3在碳的还原作用下生成铝的气态低价氧化物X(X中Al与O的质量比为6.75:2);②在碳存在下,X与N2反应生成AlN.请回答:(1)X的化学式为Al2O.
(2)碳热还原制备氮化铝的总反应化学方程式为:Al2O3(s)+3C(s)+N2(g)?2AlN(s)+3CO(g)
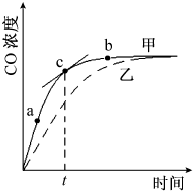
①在温度、容积恒定的反应体系中,CO浓度随时间的变化关系如下图曲线甲所示.下列说法不正确的是CD.(双选)
A.从a、b两点坐标可求得从a到b时间间隔内该化学反应的平均速率
B.c点切线的斜率表示该化学反应在t时刻的瞬时速率
C.在不同时刻都存在关系:v(N2)=3v(CO)
D.维持温度、容积不变,若减少N2的物质的量进行反应,曲线甲将转变为曲线乙
②一定温度下,在压强为p的反应体系中,平衡时N2的转化率为α,CO的物质的量浓度为c;若温度不变,反应体系的压强减小为0.5p,则N2的平衡转化率将>α(填“<”、“=”或“>”),平衡时CO的物质的量浓度B.
A.小于0.5c B.大于0.5c,小于c C.等于c D.大于c.
分析 (1)依据X中Al与O的质量比为6.75:2计算物质的量之比得到化学式;
(2)①A、图象中可以得到单位时间内的浓度变化,反应速率是单位时间内物质的浓度变化;
B、c点处的切线的斜率是此时刻物质浓度除以此时刻时间为瞬时速率;
C、化学反应速率之比等于化学方程式计量数之比分析;
D、维持温度、容积不变,若减少N2的物质的量进行反应,平衡逆向进行,达到新的平衡状态;
②该反应只有在高温下才能自发进行,结合反应自发进行的判断依据是△H-T△S<0分析.
解答 解:(1)X中Al与O的质量比为6.75:2计算物质的量之比=$\frac{6.75}{27}$:$\frac{2}{16}$=0.25:0.125=2:1,化学式为:Al2O,
故答案为:Al2O;
(2)①A、图象中可以得到单位时间内的浓度变化,反应速率是单位时间内物质的浓度变化计算得到,从a、b两点坐标可求得从a到b时间间隔内该化学反应的平均速率,故A正确;
B、c点处的切线的斜率是此时刻物质浓度除以此时刻时间,为一氧化碳的瞬时速率,故B正确;
C、化学反应速率之比等于化学方程式计量数之比分析,3v(N2)=v(CO),故C错误;
D、维持温度、容积不变,若减少N2的物质的量进行反应,平衡逆向进行,达到新的平衡状态,平衡状态与原来的平衡状态不同,故D错误;
故答案为:CD;
②若温度不变,反应体系的压强减小为0.5p,平衡向气体体积增大的方向进行,平衡正向进行,N2的平衡转化率增大,平衡时CO的物质的量浓度增大,CO的物质的量浓度大于0.5c,小于c,故选B,
故答案为:>;B.
点评 本题考查了化学式计算书写、化学平衡影响因素分析判断,主要是图象分析应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
12.可逆反应H2(g)+I2(g)?2HI(g)达到平衡时的标志是( )
| A. | H2、I2、HI的浓度相等 | |
| B. | 混合气体密度恒定不变 | |
| C. | 混合气体的质量不再改变 | |
| D. | 1个I-I键断裂的同时,有2个H-I键断裂 |
13.下列叙述中正确的是( )
| A. | 过氧化钠是淡黄色固体,久置于空气中变成白色的氢氧化钠固体 | |
| B. | 过氧化钠中阴阳离子比例为1:2 | |
| C. | 用过氧化钠漂白织物、麦秆等日久又逐渐变成黄色 | |
| D. | Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 |
17.用湿润的pH试纸测定溶液的pH,不变的是( )
| A. | HCl溶液 | B. | NaOH溶液 | C. | Na2SO4溶液 | D. | 氨水 |
7.下列叙述中正确的是( )
| A. | 在水溶液里或熔融状态下能够导电的物质叫做电解质 | |
| B. | 微粒直径在10-9 m-10-7m之间的分散系为胶体 | |
| C. | 能够电离出氢离子的化合物叫酸 | |
| D. | 胶体区别于其他分散系的本质特征是具有丁达尔效应 |
11.某溶液中含有Ba2+、Ag+、Cu2+三种离子,现用①NaOH溶液、②K2SO4溶液、③盐酸将这三种离子逐一沉淀并加以分离,则加入试剂顺序正确的是( )
| A. | ①②③ | B. | ③②① | C. | ②③① | D. | ②①③ |
5.如表根据实验事实所作结论中,正确的是( )
| 实 验 事 实 | 结 论 | |
| A | A、B两种有机物具有相同的相对分子质量和不同的结构 | A、B互为同分异构体 |
| B | 质量相同的A、B两种有机物完全燃烧生成质量相同的水 | A、B两有机物最简式相同 |
| C | A、B两种有机物结构相似具有相同的通式 | A、B互为同系物 |
| D | 分子式为C6H6的烃A既能使溴的CCl4溶液褪色,又能使酸性KMnO4溶液褪色 | A的结构简式可能是 CH2═CH-C≡C-CH═CH2 |
| A. | A | B. | B | C. | C | D. | D |

 ,F分子中含有的含氧官能团名称是羟基、羧基(顺序可以颠倒).
,F分子中含有的含氧官能团名称是羟基、羧基(顺序可以颠倒). .
. .
. 的合成线路:H2C=CHCH2CH3$\stackrel{HBrO}{→}$HOCH2CHBrCH2CH3→CH3CH2CHBrCOOH$\stackrel{NaOH(aq)△}{→}$CH3CH2CHOHCOOH.
的合成线路:H2C=CHCH2CH3$\stackrel{HBrO}{→}$HOCH2CHBrCH2CH3→CH3CH2CHBrCOOH$\stackrel{NaOH(aq)△}{→}$CH3CH2CHOHCOOH.