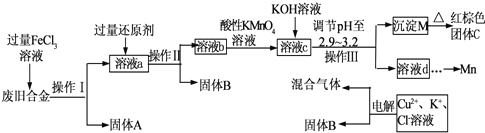
题目内容
如图是利用质量相等的Cu片和Ag片及500mL AgNO3溶液组成的原电池,一段时间后,正、负两极质量差为14g,若溶液体积不变,计算:(1)电路中转移电子的物质的量为______.
(2)溶液中AgNO3的物质的量浓度变化了______.

【答案】分析:(1)原电池的正极质量增加或者放出气体,负极质量减小,正极质量增加量+负极质量减小量=正、负两极质量差,正极和负极转移电子数相等;
(2)根据电子的转移情况计算消耗的银离子的量,进而计算溶液中AgNO3的物质的量浓度变化情况.
解答:解:Cu片和Ag片及500mL AgNO3溶液组成的原电池中,正极:Ag++e-→Ag,负极:Cu-2e-→Cu2+,设电路中转移电子的物质的量为n,则正极质量增加108n,负极质量减少32n,所以108n+32n=14g,解得n=0.1mol,故答案为:0.1mol;
(2)当电路中转移0.1mol电子时,根据正极反应:Ag++e-→Ag,则减少的银离子物质的量为0.1mol,C=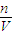 =
=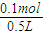 =0.2mol/L,所以溶液中AgNO3的物质的量浓度减少0.2mol/L,故答案为:0.2mol/L(减少).
=0.2mol/L,所以溶液中AgNO3的物质的量浓度减少0.2mol/L,故答案为:0.2mol/L(减少).
点评:本题考查学生原电池的工作原理以及电极反应和电子转移之间的关系知识,可以根据所学知识进行回答,难度不大.
(2)根据电子的转移情况计算消耗的银离子的量,进而计算溶液中AgNO3的物质的量浓度变化情况.
解答:解:Cu片和Ag片及500mL AgNO3溶液组成的原电池中,正极:Ag++e-→Ag,负极:Cu-2e-→Cu2+,设电路中转移电子的物质的量为n,则正极质量增加108n,负极质量减少32n,所以108n+32n=14g,解得n=0.1mol,故答案为:0.1mol;
(2)当电路中转移0.1mol电子时,根据正极反应:Ag++e-→Ag,则减少的银离子物质的量为0.1mol,C=
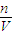 =
=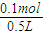 =0.2mol/L,所以溶液中AgNO3的物质的量浓度减少0.2mol/L,故答案为:0.2mol/L(减少).
=0.2mol/L,所以溶液中AgNO3的物质的量浓度减少0.2mol/L,故答案为:0.2mol/L(减少).点评:本题考查学生原电池的工作原理以及电极反应和电子转移之间的关系知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
 如图是利用质量相等的Cu片和Ag片及500mL AgNO3溶液组成的原电池,一段时间后,正、负两极质量差为14g,若溶液体积不变,计算:
如图是利用质量相等的Cu片和Ag片及500mL AgNO3溶液组成的原电池,一段时间后,正、负两极质量差为14g,若溶液体积不变,计算: