题目内容
12. 双氧水最主要的用途是漂白和杀菌消毒,在环境保护、化学合成和工业生产中有着广泛的应用.查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,如图所示.
双氧水最主要的用途是漂白和杀菌消毒,在环境保护、化学合成和工业生产中有着广泛的应用.查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,如图所示.(1)电解饱和KHSO4溶液时,阳极的电极反应式为2SO42--2e-=S2O82-,K2S2O8水解时生成H2O2和KHSO4,写出该反应的化学方程式:K2S2O8+2H2O=H2O2+2KHSO4.
(2)在碱性介质中,H2O2有较强的还原性,可与Ag2O反应,该反应中氧化剂与还原剂的物质的量之比为1:1.
(3)已知:①2H2O2(l)═2H2O(l)+O2(g)△H1=-196.46kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.84kJ•mol-1
③Cl2(g)+H2(g)═2HCl(g)△H3=-184.6kJ•mol-1
用H2O2(1)可除去工业尾气中的Cl2(g),生成HCl(g)和O2(g),该反应的热化学方程式为Cl2(g)+H2O2(l)═2HCl(g)+O2(g)△H=+3.01kJ•mol-1.
(4)该同学用此法制取一定浓度的H2O2溶液,并进行下列实验测定H2O2的质量分数.
I.将5.00mL H2O2溶液(密度为1g•cm-3)置于锥形瓶中加水稀释,再加稀硫酸酸化;
Ⅱ.用0.100 0mol•L-1 KMnO4溶液滴定;
Ⅲ.用同样的方法滴定,三次滴定消耗KMnO4溶液的体积分别为20.00mL、19.98mL、20.02mL.
①操作Ⅱ中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随滴定过程中Mn2+的增多,溶液的紫红色消失速率加快.Mn2+的作用是作催化剂.
②配平H2O2与酸性高锰酸钾溶液反应的离子方程式:
2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
③原H2O2溶液中溶质的质量分数为3.4%.
分析 (1)工业上用电解KHSO4饱和溶液制取H2O2,电解时,阳极上硫酸根失去电子,发生氧化反应生成S2O82-,K2S2O8水解时生成H2O2和KHSO4,根据元素守恒可写出该反应的化学方程式;
(2)在碱性介质中,H2O2有较强的还原性,可与Ag2O反应,生成银单质和水,根据电子得失守恒可知该反应中氧化剂与还原剂的物质的量之比;
(3)已知:①2H2O2(l)═2H2O(l)+O2(g)△H1=-196.46kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.84kJ•mol-1
③Cl2(g)+H2(g)═2HCl(g)△H3=-184.6kJ•mol-1
根据盖斯定律,将①×$\frac{1}{2}$+②+③可得,H2O2(1)与Cl2(g)反应生成HCl(g)和O2(g)的反应热,据此可写出该反应的热化学方程式;
(4)①根据操作Ⅱ中现象可知,反应生成的Mn2+对高锰酸钾与双氧水的反应有催化作用,据此答题;
②H2O2与酸性高锰酸钾溶液反应中,锰元素从+5价降为+2价,氧元素从-1价变为0价,根据元素守恒和电荷守恒可书写出反应的离子方程式:
③根据题意,三次滴定消耗KMnO4溶液的体积平均值为20.00mL,所以KMnO4的物质的量为0.100 0mol•L-1×20.00mL=0.002mol,根据关系式2KMnO4~5H2O2可得H2O2的质量,据此可求得H2O2溶液中溶质的质量分数.
解答 解:(1)工业上用电解KHSO4饱和溶液制取H2O2,电解时,阳极上硫酸根失去电子,发生氧化反应生成S2O82-,电极反应式为2SO42--2e-=S2O82-,K2S2O8水解时生成H2O2和KHSO4,根据元素守恒可知该反应的化学方程式为K2S2O8+2H2O=H2O2+2KHSO4,
故答案为:2SO42--2e-=S2O82-; K2S2O8+2H2O=H2O2+2KHSO4;
(2)在碱性介质中,H2O2有较强的还原性,可与Ag2O反应,生成银单质和水,根据电子得失守恒可知,1molH2O2能失去2mol电子,1molAg2O能得2mol电子,所以反应中氧化剂与还原剂的物质的量之比为1:1,
故答案为:1:1;
(3)已知:①2H2O2(l)═2H2O(l)+O2(g)△H1=-196.46kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.84kJ•mol-1
③Cl2(g)+H2(g)═2HCl(g)△H3=-184.6kJ•mol-1
根据盖斯定律,将①×$\frac{1}{2}$-②+③可得,H2O2(1)与Cl2(g)反应生成HCl(g)和O2(g)的反应热△H=(-196.46×$\frac{1}{2}$+285.84-184.6)kJ•mol-1=+3.01kJ•mol-1,所以该反应的热化学方程式为Cl2(g)+H2O2(l)═2HCl(g)+O2(g)△H=+3.01kJ•mol-1 ,
故答案为:Cl2(g)+H2O2(l)═2HCl(g)+O2(g)△H=+3.01kJ•mol-1;
(4)①根据操作Ⅱ中现象可知,反应生成的Mn2+对高锰酸钾与双氧水的反应有催化作用,作催化剂,
故答案为:作催化剂;
②H2O2与酸性高锰酸钾溶液反应中,锰元素从+5价降为+2价,氧元素从-1价变为0价,根据元素守恒和电荷守恒可知反应的离子方程式为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,
故答案为:2、5、6、2、8、5O2↑:
③根据题意,三次消耗KMnO4溶液的体积分别为20.00mL、19.98mL、20.02mL,则体积平均值为:20.00mL,则消耗高锰酸根的量:0.1mol/L×0.02L=0.002mol,设双氧水的物质的量为n,则
2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
2 5
0.002mol n
解得n=0.005mol,所以双氧水的质量为:0.005mol×34g/mol=0.17g,双氧水的质量分数=$\frac{0.17g}{5.00mL×1.00g/mL}$×100%=3.4%,
故答案为:3.4%.
点评 本题既考了学生的实验设计能力,综合性比较强要求学生具有分析和解决问题的能力,还与生活实际相联系,综合性比较强.本考点经常出现在实验题中,同学们要认真掌握.本题考查难度较大.

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案①生活中的玻璃、陶瓷、水泥属于上述材料中的无机非金属材料,其生产原料不需要使用石灰石的是陶瓷.用氢氟酸雕刻玻璃的化学方程式4HF+SiO2=SiF4↑+2H2O.
②我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等.用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:
| 纤维编号 | ① | ② | ③ |
| 灼烧时的气味 | 特殊气味 | 烧纸气味 | 烧焦羽毛气味 |
| A. | 尼龙 | B. | 黏胶纤维 | C. | 硝化纤维 | D. | 醋酸纤维 |
| A. | Q1+Q2<2Q3 | B. | Q1+Q2>Q3 | C. | Q1+Q2<Q3 | D. | Q1+Q2>2Q3 |
| A. | 0.2mol | B. | 0.4mol | C. | 0.6mol | D. | 0.8mol |
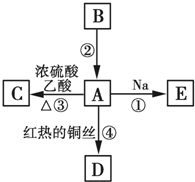 A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示:
A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示: CH3COOC2H5+H2O
CH3COOC2H5+H2O
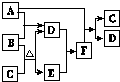 有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系:
有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系: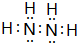 .
.