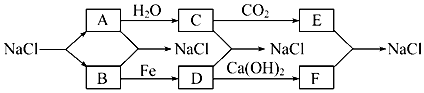
题目内容
8.2009年底在丹麦哥本哈根召开了全球气候会议,环境问题已受到世界各国的普遍关注.请回答:a.现有①氟氯烃、②二氧化碳、③二氧化硫、④废弃塑料制品、⑤氮气.能形成酸雨的是③(填序号,下同);能破坏臭氧层的是①;导致温室效应的主要气体是②.
b.“白色污染”的主要危害是①②③④(填序号).
①破坏土壤结构②降低土壤肥效③污染地下水④危及海洋生物的生存.
分析 a.SO2在空气中会转化亚硫酸甚至硫酸,是导致酸雨的主要气体之一;大量排放CO2将导致温室效应;氟氯烃是破坏臭氧层的罪魁祸首;
b.聚苯乙烯、聚丙烯、聚氯乙烯等高分子化合物制成的各类塑料制品使用后被弃置成为固体废物对环境的污染称为“白色污染”,由于随意乱丢乱扔,难于降解处理,会破坏土壤结构、降低土壤肥效,污染地下水以及危及海洋生物的生存.
解答 解:a.SO2在空气中会转化亚硫酸甚至硫酸,是导致酸雨的主要气体之一,;二氧化碳是一种温室气体,大量排放CO2将导致温室效应;氟氯烃能破坏臭氧层
故答案为:③;①;②;
b.“所谓“白色污染”,是人们对塑料垃圾污染环境的一种形象称谓.它是指用聚苯乙烯、聚丙烯、聚氯乙烯等高分子化合物制成的各类生活塑料制品使用后被弃置成为固体废物,由于随意乱丢乱扔,难于降解处理,会破坏土壤结构、降低土壤肥效,污染地下水以及危及海洋生物的生存等,题目中四个选项都正确.
故答案为:①②③④.
点评 本题考查环境污染及治理,为高频考点,侧重于化学与生活、环保的考查,有利于培养学生良好的科学素养,题目难度不大,本题注意把握相关物质的污染性以及治理方法.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
18.下列物质的提纯可行的是( )
| A. | 通过灼热的CuO除去H2中的CO | |
| B. | 通过氢氧化钠溶液除去SO2中的CO2 | |
| C. | 滴加适量氢氧化钡溶液除去NaOH溶液中少量的Na2CO3 | |
| D. | 滴加适量KCl溶液除去KNO3溶液中少量的AgNO3 |
19.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 标准状况下,22.4L SO3中含有氧原子数目为3.0NA | |
| B. | 常温常压下,12.2g NaHSO4中含有离子总数为0.3NA | |
| C. | 在标准状况下,11.2L N2和O2混合气体中所含分子数为0.5NA | |
| D. | 某密闭容器盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
16. 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解铜9.6g(已知硝酸只被还原为NO气体);向另一份中逐渐加入铁粉,产生气体的量随铁质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解铜9.6g(已知硝酸只被还原为NO气体);向另一份中逐渐加入铁粉,产生气体的量随铁质量增加的变化如图所示.下列分析或结果错误的是( )
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解铜9.6g(已知硝酸只被还原为NO气体);向另一份中逐渐加入铁粉,产生气体的量随铁质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解铜9.6g(已知硝酸只被还原为NO气体);向另一份中逐渐加入铁粉,产生气体的量随铁质量增加的变化如图所示.下列分析或结果错误的是( )| A. | 另一份溶液中最终溶质为FeSO4 | |
| B. | OA段产生是NO,AB段反应为2Fe3++Fe═3Fe2+,BC段产生氢气 | |
| C. | 原混合液中NO3-的物质的量为0.2mol | |
| D. | 原混合液中c(H2SO4)为2.5mol•L-1 |
3.下列能够检验出KI中是否含有Br-的实验是( )
| A. | 加入足量的新制氯水,溶液变色则有Br- | |
| B. | 加入酸性KMnO4溶液,观察溶液颜色是否褪去 | |
| C. | 加入硝酸银溶液,再加稀硝酸,若有浅黄色沉淀则有Br- | |
| D. | 加入足量FeCl3溶液,用CCl4萃取后,在无色的水层中加入氯水,溶液呈橙黄色,则含有Br- |
13.下列混合物分离(或除杂)、鉴别的方法不正确的是( )
| A. | 用加热法除去 Na2CO3 固体中的少量 NaHCO3 | |
| B. | Fe(OH)3 中含有少量 Al(OH)3 可用 NaOH 溶液除去 | |
| C. | Fe2+中含有少量 Fe3+,加入 Fe 单质 | |
| D. | 滴加 BaCl2溶液,形成白色沉淀,可以检验溶液中含有 SO 42- |
20.下表是部分短周期元素的信息,用化学用语回答下列问题
(1)元素A在周期表中的位置第二周期ⅣA族,B的某种核素中中子数比质子数多1,则表示该核素的原子符号为715N.
(2)写出钙与M原子个数比为1:2化合物的电子式 ,此化合物中含有的化学键类型(填离子键,共价键或非极性键)离子键和非极性键共价键.
,此化合物中含有的化学键类型(填离子键,共价键或非极性键)离子键和非极性键共价键.
(3)M2-、E3+、G2-离子半径大小顺序是S2->O2->Al3+(用离子符号回答)
(4)由A、B、M及氢四种原子构成的分子A2H5BM2,既可以和盐酸反应又可以和氢氧化钠溶液反应,写出A2H5BM2的名称甘氨酸.
(5)以E和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时,NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是Al+3NiO(OH)+NaOH+H2O=3Ni(OH)2+NaAlO2
(6)工业上可用电解法制取Ni2O3,用NaOH溶液调NiCl2溶液的pH至7.5,加入适量Na2SO4后利用惰性电极电源,电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍,ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为ClO-+2Ni(OH)2═Cl-+Ni2O3+2H2O.当amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为1.25a mol.
| 元素代号 | A | B | F |
| 原子半径/nm | 0.077 | 0.075 | 0.117 |
| 主要化合价 | +4、-4 | +5、-3 | +4、-4 |
| 元素 | D | M | G | E |
| 性质结构信息 | 单质制成的高压灯,发出的黄光透雾力强,射程远 | 氢化物常温下呈液态,M的双原子阴离子有18个电子 | 原子核外的M层比L层少2个电子 | +3价阳离子的核外电子排布与氖原子相同 |
(2)写出钙与M原子个数比为1:2化合物的电子式
 ,此化合物中含有的化学键类型(填离子键,共价键或非极性键)离子键和非极性键共价键.
,此化合物中含有的化学键类型(填离子键,共价键或非极性键)离子键和非极性键共价键.(3)M2-、E3+、G2-离子半径大小顺序是S2->O2->Al3+(用离子符号回答)
(4)由A、B、M及氢四种原子构成的分子A2H5BM2,既可以和盐酸反应又可以和氢氧化钠溶液反应,写出A2H5BM2的名称甘氨酸.
(5)以E和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时,NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是Al+3NiO(OH)+NaOH+H2O=3Ni(OH)2+NaAlO2
(6)工业上可用电解法制取Ni2O3,用NaOH溶液调NiCl2溶液的pH至7.5,加入适量Na2SO4后利用惰性电极电源,电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍,ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为ClO-+2Ni(OH)2═Cl-+Ni2O3+2H2O.当amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为1.25a mol.
16.如表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,Y的周期数为其族序数.下列说法正确的是
( )
( )
| X | ||
| Y | Z | W |
| T |
| A. | 含Y元素的盐水溶液可呈酸性或碱性 | |
| B. | 气态氢化物的稳定性:X>W>Z | |
| C. | 根据元素周期律推测,金属性T比Y强 | |
| D. | Z单质性质不活泼.在自然界中有游离态 |