题目内容
5.常温时,下列关于电解质溶液的叙述正确的是( )| A. | 稀释 pH=4的醋酸,溶液中c(OH-)离子的浓度降低 | |
| B. | pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 | |
| C. | 0.2 mol/L的盐酸与等体积水混合后pH=1 | |
| D. | 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
分析 A、稀释醋酸溶液时,溶液中c(OH-)增大;
B、pH=3的醋酸溶液,与pH=11的氢氧化钠溶液中:c(H+)=c(OH-)=1×10-3mol/L,但醋酸为弱酸,不完全电离,醋酸浓度大;
C、0.2 mol•L-1的盐酸与等体积水混合后,混合后溶液的体积是原来的2倍,所以氢离子的浓度是原来的一半;
D、硫酸是强电解质,溶液中完全电离,醋酸是弱电解质,部分电离.
解答 解:A、稀释醋酸溶液时,溶液中氢离子浓度减小,温度不变,水的离子积常数不变,则溶液中c(OH-)增大,故A错误;
B、pH=3的醋酸溶液,与pH=11的氢氧化钠溶液中:c(H+)=c(OH-)=1×10-3mol/L,但醋酸为弱酸,不完全电离,醋酸浓度大,与pH=11的氢氧化钠溶液等体积混合后,醋酸过量,溶液pH<7,故B错误;
C、0.2 mol•L-1的盐酸与等体积水混合后,混合后溶液的体积是原来的2倍,所以氢离子的浓度是原来的一半,所以与等体积水混合后c(H+)=0.1 mol/L,故C正确;
D、c(H+)=10-PH,硫酸是强电解质,氢离子完全电离出来;醋酸是弱电解质,氢离子部分电离,c(醋酸)>c(H+),所以醋酸消耗的氢氧化钠比硫酸多,故D错误.
故选C.
点评 本题考查了水的电离平衡影响因素,溶液pH计算,酸与碱混合后溶液pH的判断,其中B选项学生要注意醋酸是弱电解质,醋酸溶液中存在大量的醋酸分子,题目难度中等.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目
16.在一密闭容器中,反应2A(g)?2B(g)+C(?)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度变为原来的60%,则( )
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率降低了 | ||
| C. | C为气态 | D. | C为固态或液态 |
13.下列方法中可以说明2HI(g)?H2(g)+I2(g)已达到平衡的标志是( )
| A. | c(HI):c(H2):c(I2)=2:1:1时 | |
| B. | 温度和体积一定时,容器内压强不再变化 | |
| C. | 条件一定,混合气体的平均相对分子质量不再变化 | |
| D. | 温度和体积一定时,混合气体的颜色不再变化 |
20.下列材料中,不属于通常所说的三大合成材料的是( )
| A. | 塑料 | B. | 合成纤维 | C. | 蛋白质 | D. | 合成橡胶 |
10.对化学反应3X(g)+Y(g)?2Z(g)+2Q(s)达到平衡后,增大压强,下列关于对该化学反应产生的影响的说法正确的是( )
| A. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| B. | 正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 | |
| C. | 正、逆反应速率都增大,平衡向正反应方向移动 | |
| D. | 正、逆反应速率都没有变化,平衡不发生移动 |
17.决定化学反应速率的主要因素是( )
| A. | 反应温度 | B. | 使用催化剂 | C. | 压强 | D. | 反应物性质 |
12.工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气.对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用.
Ⅰ脱硝:已知:H2的热值为142.9KJ•g-1
N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
H2O(g)=H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在恒温恒容的条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
(1)该反应v-t图象如图甲所示;若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.现有下列叙述:
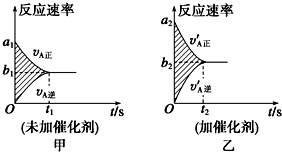
①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2.
则以上所述各项正确的组合为B
A.②④⑥B.②④⑤C.②③⑤D.②③⑥
(2)下列叙述能说明此反应达到平衡状态的是abe.
a、混合气体的平均相对分子质量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
(3)该反应过程中部分数据见表:
①30min时,反应到达平衡状态了吗?是(填“是”或“否”)简述理由从20min到30min时各物质的浓度没有发生改变
②前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1,平衡时H2的浓度c(H2)=1.5mol•L-1,平衡时CO2的转化率=50%
③在其它条件不变下,若20min时往密闭容器中通入1mol氖气,此时该反应速率将不变(填“变大”、“变小”或“不变”,下同);若20min时往密闭容器中通入1mol氢气,此时该反应速率将变大.
Ⅰ脱硝:已知:H2的热值为142.9KJ•g-1
N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
H2O(g)=H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在恒温恒容的条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
(1)该反应v-t图象如图甲所示;若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.现有下列叙述:

①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2.
则以上所述各项正确的组合为B
A.②④⑥B.②④⑤C.②③⑤D.②③⑥
(2)下列叙述能说明此反应达到平衡状态的是abe.
a、混合气体的平均相对分子质量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
(3)该反应过程中部分数据见表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 0 min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | |||
| 20min | 1 | |||
| 30min | 1 |
②前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1,平衡时H2的浓度c(H2)=1.5mol•L-1,平衡时CO2的转化率=50%
③在其它条件不变下,若20min时往密闭容器中通入1mol氖气,此时该反应速率将不变(填“变大”、“变小”或“不变”,下同);若20min时往密闭容器中通入1mol氢气,此时该反应速率将变大.
