题目内容
(12分)同学们课外探究酸的性质活动中将以下8个实验分为三组进行(如下图所示)。
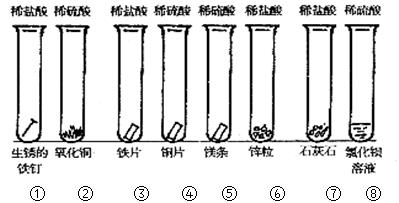
(1)这8个实验是如何分组的?请写出各组的试管编号:
第一组 第二组 第三组 ,
你认为如此分组的依据是: 。
(2)写出试管②⑤的实验现象及有关的离子方程式:
② ; 。
。
⑤ ; 。
(3)请作为课外活动小组成员,根据实验及现象的分析、比较,归纳出的结论(至少答3条):
①_________________________________________________;
②_________________________________________________;
③__________________________________________________。

(1)这8个实验是如何分组的?请写出各组的试管编号:
第一组 第二组 第三组 ,
你认为如此分组的依据是: 。
(2)写出试管②⑤的实验现象及有关的离子方程式:
② ;
 。
。⑤ ; 。
(3)请作为课外活动小组成员,根据实验及现象的分析、比较,归纳出的结论(至少答3条):
①_________________________________________________;
②_________________________________________________;
③__________________________________________________。
(1)(5分)第一组①②;第二组③④⑤⑥;第三组⑦⑧;(各1分) 因为本实验的目的是研究强酸(盐酸和硫酸)分别与金属氧化物、金属、盐的反应 ,所以如此分类。(2分)
,所以如此分类。(2分)
(2) (共4分,现象各1分、离子方程式各1分)
② 固体溶解,得到蓝色的溶液 ; CuO+2H+=Cu2++H2O。
⑤ 镁条溶解,产生大量气体 ; Mg +2H+=Mg2++H2↑.
(3)(共3分写出其中三个点给满分)
①酸能跟某些金属氧化物反应;②酸能跟某些盐反应;③酸能跟多种活泼金属反应;
④酸并不能跟所有金属反应;⑤酸与活泼金属反应时速度不同
 ,所以如此分类。(2分)
,所以如此分类。(2分)(2) (共4分,现象各1分、离子方程式各1分)
② 固体溶解,得到蓝色的溶液 ; CuO+2H+=Cu2++H2O。
⑤ 镁条溶解,产生大量气体 ; Mg +2H+=Mg2++H2↑.
(3)(共3分写出其中三个点给满分)
①酸能跟某些金属氧化物反应;②酸能跟某些盐反应;③酸能跟多种活泼金属反应;
④酸并不能跟所有金属反应;⑤酸与活泼金属反应时速度不同
略

练习册系列答案
相关题目
 ⑥托盘天平。配制时,必须使用的仪器或用品有
⑥托盘天平。配制时,必须使用的仪器或用品有  (填序号),还缺少的仪器是 。
(填序号),还缺少的仪器是 。 m~2cm。
m~2cm。 入容量
入容量 瓶。
瓶。 _,将溶液转入________中,洗涤,定容,摇匀。
_,将溶液转入________中,洗涤,定容,摇匀。 填“能”或“不能”)配制1.0 mol·L-1 Ba(OH)2溶液。
填“能”或“不能”)配制1.0 mol·L-1 Ba(OH)2溶液。 ______(填“偏高”、“不变”或“偏低”)。
______(填“偏高”、“不变”或“偏低”)。 器.
器.