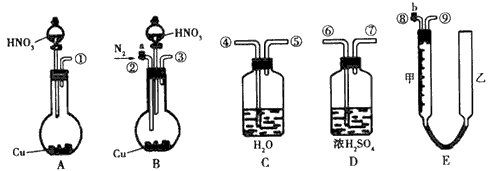
题目内容
向50 mL 1 mol·L-1的Al2(SO4)3溶液中加入100 mL KOH溶液,充分反应得到3.9 g 沉淀,则KOH溶液的物质的浓度可能是( )A.1 mol·L-1 B.3 mol·L-1 C.1.5 mol·L-1 D.3.5 mol·L-1
解析:根据Al3+的物质的量与沉淀Al(OH)3的物质的量比较可推测KOH的两种情况:
①加入氢氧化铝不足量时,n(KOH)=3n〔Al(OH)3〕=3×![]() =0.15 mol
=0.15 mol
c(KOH)=![]() =1.5 mol·L-1
=1.5 mol·L-1
②当KOH过量时,n(KOH)=4n(Al3+)-n〔Al(OH)3〕=0.4 mol-0.05 mol=0.35 mol。
c(KOH)=![]() =3.5 mol·L-1。
=3.5 mol·L-1。
答案:CD

 综合自测系列答案
综合自测系列答案如图为向盛有0.2 mol•L-1 50 mL明矾溶液中,慢慢加入0.1 mol•L-1 Ba(OH)2溶液,生成沉淀的质量随着加入Ba(OH)2溶液的体积变化的图像,当产生的沉淀量最大时(即B点)改加0.5 mol•L-1 HCl.沉淀总质量又发生变化(虚线部分)。

⑴写出OA、AB、C、CD四段发生反应的化学方程式。
⑵计算A、B、C、D点所加入Ba(OH)2溶液、盐酸体积及沉淀质量并填入下表。
|
|
A |
B |
|
V[Ba(OH)2]/mL |
|
|
|
m(沉淀)/g |
|
|
Ⅰ.实验室称取0.867 g草酸钠(Na2C2O4,式量为134),溶解于水,加入一定量硫酸,用未知浓度的KMnO4溶液滴定,用去KMnO4溶液22.50 mL,反应式如下(未配平):
MnO4- + C2O42- + H+ → Mn2+ + CO2 + H2O。
则装KMnO4的滴定管是_______(填“酸式”或“碱式”); KMnO4溶液的浓度是________mol/L。
Ⅱ.某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g)![]() N(g)+H2(g)
N(g)+H2(g)
| 起始n(M):n(H2O) | M转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.33 |
| 1:3 | 0.75 | 0.25 |
①该反应的平衡常数为 。该温度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
②结合表中数据,判断下列说法中正确的是 。
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的量之比为1:4时,M的转化率为0.85
③该温度下,向容器中充入2molM、2mol H2O ,当达平衡时放出a KJ热量,则该反应的
△H=
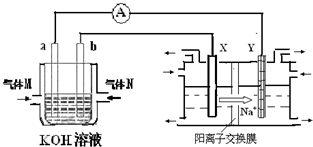 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.