题目内容
【题目】为解决能源危机,有人提出用CaCO3制取C2H2作燃料。具体反应为:
① CaCO3(s)![]() CaO(s)+CO2(g)
CaO(s)+CO2(g)
② CaO(s)+3C(s)![]() CaC2(s)+CO(g)
CaC2(s)+CO(g)
③ CaC2(s)+H2O(l)![]() CaO(s)+C2H2(g)
CaO(s)+C2H2(g)
(1)制备1mol C2H2(g)需一定量的C(s),这些炭完全燃烧可放热__________kJ
(2)若1mol C2H2完全燃烧可放出热量1298kJ,则将C2H2(g)作为燃料是否合算?说明理由__________。
(3)为什么反应①和②需要高温,反应③只需常温__________(已知有关物质的△Hf(298k)/kJ·mol-1为:CaC2(s):—60,CO2(g):—393,H2O(l):—285,C2H2(g):227,CaO(s):—635,CaCO3(s):—1207,CO(g):—111)
【答案】1179 kJ 虽然燃烧1mol C2H2(g)放热多于燃烧3 mol C(s)。但反应△rH(298K,①)=+179 kJ/mol,△rH(298K,②)=+464kJ/mol,△rH(298K,③)=-63kJ/mol。即制取1mol乙炔还需消耗(179+464) kJ热量,且反应③放出的热量不能完全利用,不合算。 三个反应的熵变均大于零。反应(1)和(2)是吸热反应,因此高温有利于反应。反应(3)是放热反应,因此常温有利于反应。
【解析】
(1)根据盖斯定律,制取1mol C2H2(g)需3 mol C(s)(36g),反应C(g)+O2(g)=CO2(g)
ΔH=-393 kJ/mol,故3mol C完全反应放出3×393=1179kJ的能量;
(2)虽然燃烧1mol C2H2(g)放热多于燃烧3 mol C(s)。但反应△rH(298K,①)=+179kJ/mol,△rH(298K,②)=+464kJ/mol,△rH(298K,③)=-63kJ/mol。即制取1mol乙炔还需消耗(179+464)KJ热量,且反应③放出的热量不能完全利用,不合算。
(3)三个反应的熵变均大于零。反应(1)和(2)是吸热反应,因此高温有利于反应。反应(3)是放热反应,因此常温有利于反应。

【题目】I.配制250mL0.5mol/L的NaOH溶液,所需的仪器有烧杯、玻璃棒、托盘天平、胶头滴管和_______。定容时俯视观察刻度线,其结果_______。(填“偏大”、“偏小”、或“不变”)
Ⅱ.实验室用加热固体氯化铵和氢氧化钙的混合物制取氨气,反应的化学方程式是_______;所制得的气体中常含有少量杂质气体,为了得到纯净的氨气并加以检验,请在下列装置或试剂中,根据要求作出合适选择,并将对应选择的装置编号字母填入表中的空格处:
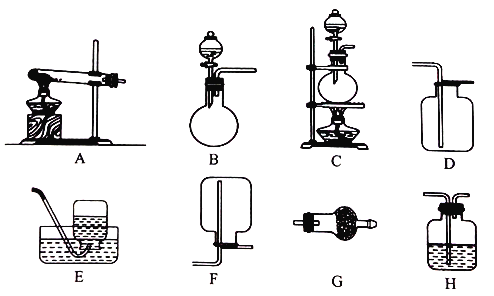
试剂:a. NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液 e.碱石灰
f.品红溶液 g.湿润的红色石蕊试纸
制取气体 | 杂质气体 | 制取气体的 发生装置 | 收集装置 | 净化装置中 所用的试剂 | 检验制得的气体 所用试剂 |
NH3 | H2O(g) | _______ | F | e | _______ |