题目内容
1.硝酸和铜反应时,硝酸浓度不同,产物也不同,反应方程式如下:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O ①
3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O ②
回答下列问题:
(1)若反应②中消耗9.6g Cu,则可收集到标准状况下2.24L气体.
(2)实验室为比较浓、稀硝酸分别与铜反应的不同,需配制100mL 2mol•L-1稀硝酸.
已知实验中所用浓硝酸的浓度为63%,密度为1.42g•mL-1,该浓硝酸的物质的量浓度为14.2
14.2mol•L-1,他们需要量取14.1mL浓硝酸(保留到小数点后一位数字).
(3)如下图所示仪器,在配制过程中不需用到的是A(填序号).
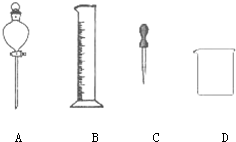
除图中已有的仪器外,配制上述溶液还需用到的玻璃仪器有玻璃棒、100mL容量瓶.
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
①实验前洗净容量瓶后没有干燥,瓶内残留有少量蒸馏水不影响.
②定容时仰视偏低.
分析 (1)先计算9.6gCu的n(Cu),然后化学方程式得出生成的n(NO),带入V=nVm计算体积;
(2)根据c=$\frac{1000ρω}{M}$计算浓硝酸的物质的量浓度,根据稀释定律计算所需浓硝酸的体积;
(3)配置100ml 2mol•L-1稀硝酸需要的主要玻璃仪器有烧杯、量筒、胶头滴管、100ml容量瓶;
(4)根据c=$\frac{n}{V}$分析,c与n成正比,c与V成反比.
解答 解:(1)n(Cu)=$\frac{9.6g}{64g/mol}$=0.15mol,3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,生成的n(NO)=$\frac{2}{3}$n(Cu)=$\frac{2}{3}$×0.15mol=0.1mol,在标准状态下的体积V(NO)=0.1mol×22.4L/mol=2.24L,
故答案为:2.24;
(2)浓硝酸的物质的量浓度c=$\frac{1000ρω}{M}$=$\frac{1000×1.42×63%}{63}$mol/L=14.2 mol/L,
根据稀释定律,配制100mL 2mol•L-1稀硝酸所需该浓硝酸的体积为$\frac{100mL×2mol•L{\;}^{-1}}{14.2mol•{L}^{-1}}$=14.1 ml,
故答案为:14.2;14.1;
(3)配置100ml 2mol•L-1稀硝酸需要的主要玻璃仪器有烧杯、量筒、胶头滴管、玻璃棒、100ml容量瓶,不需要分液漏斗,
故答案为:A;玻璃棒、100mL容量瓶;
(4)①实验前洗净容量瓶后没有干燥,瓶内残留有少量蒸馏水,对n、V均没有影响,因此浓度的大小无影响,
故答案为:不影响;
②定容时仰视,导致V偏大,因此c偏低,
故答案为:偏低.
点评 本题考查一定物质的量浓度溶液的配置及误差分析,为高频考点,侧重于计算能力和分析能力的培养,题目难度中等,注意掌握物质的量浓度与质量分数的换算公式.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案| A. | 明矾可用于净水 | |
| B. | 氯水保存在棕色瓶中,并置于冷暗处 | |
| C. | 氯元素在自然界主要以氯气形式存在 | |
| D. | 氯气被广泛用于医药合成、农药生产等方面 |
A.湿润的淀粉KI试纸 B.氯气 C.饱和食盐水
D.蒸发结晶 E.萃取 F.蒸馏
| 实验要求 | 化学试剂或实验方法 |
| 检验HCl中是否含Cl2 | |
| 从海水中获取淡水 | |
| 将Br2从水中分离出来 |
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应 | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| D. | FeCl3+3KSCN?3KCl+Fe(SCN)3 体系中加入KCl固体,平衡向逆反应方向移动 |
| A. | 1.2×10-5 mol•L-1 | B. | 2.4×10-4 mol•L-1 | ||
| C. | 3.6×10-4 mol•L-1 | D. | 4.8×10-4 mol•L-1 |
 )的二氯取代物有10种,则萘的六氯代物有10.
)的二氯取代物有10种,则萘的六氯代物有10.