题目内容
将过量铁粉放入100mL2mol/L的 HNO3溶液中,假设还原产物只有 NO且 HNO3 完全反应,则参加反应Fe的质量为( )
| A、2.8g | B、4.2g |
| C、11.2g | D、5.6g |
考点:化学方程式的有关计算
专题:计算题
分析:将过量铁粉放入100mL 2mol/L的HNO3溶液中,假设还原产物只有NO且HNO3完全反应,反应的离子方程式为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,依据反应定量关系计算.
解答:
解:反应的离子方程式为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,100mL 2mol/L的HNO3溶液中含有0.1L×2mol/L=0.2mol,
假设还原产物只有NO且HNO3完全反应,3Fe~8H+,
计算得到反应的铁物质的量=
mol=0.075mol,反应的铁的质量=0.075mol×56g/mol=4.2g,
故选B.
假设还原产物只有NO且HNO3完全反应,3Fe~8H+,
计算得到反应的铁物质的量=
| 0.2×3 |
| 8 |
故选B.
点评:本题考查了稀硝酸反应的离子方程式定量计算应用,主要是离子方程式的定量分析是解题关键,题目难度中等.

练习册系列答案
相关题目
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度.则下列说法正确的是( )
| A、物质的量:甲<乙 |
| B、气体体积:甲>乙 |
| C、摩尔体积:甲>乙 |
| D、相对分子质量:甲>乙 |
200℃时,11.6g CO2和水蒸气的混合气体与足量的Na2O2充分反应后,固体质量增加了3.6g,则原混合气体的平均摩尔质量为( )
| A、5.8 g?mol-1 |
| B、11.6 g?mol-1 |
| C、23.2 g?mol-1 |
| D、46.4 g?mol-1 |
短周期元素R、T、X、Y、Z在元素周期表的相对位置如表所示,它们的核外电子数之和为58.则下列判断不正确的是( )
| R | T | |
| X | Y | Z |
| A、R的其中一种单质可用做电极材料 |
| B、五种元素中原子半径最大的是X |
| C、气态氢化物稳定性:Y>T |
| D、Z元素的最高价氧化物对应的水化物的化学式为HZO4 |
下列关于油脂的叙述不正确的是( )
| A、油脂是一种混合物 |
| B、油脂属于酯类 |
| C、油脂是高级脂肪酸甘油酯 |
| D、油脂都不能使溴水褪色 |

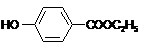 ,生产过程如下图:
,生产过程如下图: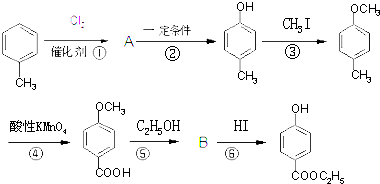
 的分子式为
的分子式为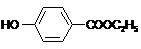 中的含氧官能团名称是
中的含氧官能团名称是 ,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是
,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是