题目内容
2.下列说法正确的是( )| A. | 单质硅化学性质稳定,但自然界不存在游离态的硅 | |
| B. | 氨气的水溶液能导电,说明氨气是电解质 | |
| C. | SO2使溴水或品红溶液褪色,体现了SO2的漂白性 | |
| D. | 镁、铝、铜等金属一般采用热还原法冶炼 |
分析 A.硅属于亲氧元素,在自然界中以化合态存在;
B.氨气溶于水生成一水合氨,一水合氨是电解质;
C.二氧化硫具有还原性,能够与溴水发生氧化还原反应,使溴水褪色;
D.工业上用电解熔融氯化镁得到镁,用电解氧化铝制备铝.
解答 解:A.硅属于亲氧元素,在自然界中以化合态存在,不存在单质硅,故A正确;
B.氨气溶于水生成一水合氨,一水合氨是电解质,氨气本身不能电离,属于非电解质故B错误;
C.二氧化硫使溴水褪色,体现二氧化硫还原性,与漂白性无关,故C错误;
D.铝及铝前的金属性质活泼,通常用电解法制备,例如电解熔融氯化镁制备镁,电解氧化铝制备铝,故D错误;
故选:A.
点评 本题考查了元素化合物知识,熟悉硅、电解质、二氧化硫的性质,熟悉金属冶炼的一般原理是解题关键,注意相关知识的积累.

练习册系列答案
 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
9.高铁电池是一种新型可充电电池,电解液为KOH溶液,放电时的总反应式为:3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH下列叙述正确的是( )
| A. | 放电时,正极区溶液的pH减小 | |
| B. | 该电用电可用稀H2SO4代替KOH溶液 | |
| C. | 充电时,电解质溶液中的K+等阳离子向Zn电极移动 | |
| D. | 充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原 |
13.从海带中提取碘,可经过如图实验步骤完成.下列有关说法正确的是( )

| A. | 灼烧过程中使用的玻璃仪器有酒精灯、坩埚、玻璃棒 | |
| B. | 氧化过程中发生反应的离子方程式为:2I-+H2O2→I2+2OH- | |
| C. | 检验碘单质时,可选用淀粉碘化钾试纸,若试纸变蓝说明有碘单质 | |
| D. | 分液时,先打开活塞放出下层液体,再关闭活塞倒出上层液体 |
7.向一种溶液中滴加另一种溶液后,溶液的颜色不发生显著变化的是( )
| A. | 硝酸亚铁溶液中加入稀硫酸 | |
| B. | 含有酚酞的碳酸钠溶液中加入足量的氧化钙溶液 | |
| C. | 硫酸铜溶液中滴加硝酸钡溶液 | |
| D. | 高锰酸钾酸性溶液中滴加亚硫酸钠溶液 |
14.短周期元素X、Y、Z、W、Q原子序数逐渐增大,X的氢化物极易溶于Y的氢化物,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.由此得出的正确结论是( )
| A. | 元素Y的最高正价是+6 | |
| B. | 离子半径的大小顺序为W>Q>Z>X>Y | |
| C. | 元素X的最高价氧化物对应水化物的酸性比Q的强 | |
| D. | 氢化物的沸点Y>W |
11.下列反应的离子方程式书写正确的是( )
| A. | 钠和水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| C. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
12.分子量为177的某无机物中含C、H、O、Br四种元素,实验还测知化合物中氢元素与碳元素的质量比为1:8,该有机物的分子式是( )
| A. | C2H6Br2O | B. | C6H9BrO | C. | C2H3Br2O | D. | C3H6BrO |

 ;其水溶液在空气中放置易变浑浊,写出反应的化学方程式2H2S+O2→2S↓+2H2O;该变化说明S的非金属性比O弱(填“强”或“弱”),从原子结构的角度解释原因:硫原子半径大于氧原子,硫原子的电子能力小于氧原子.通过H2O的稳定性大于H2S或SO2中硫是+4价,氧是-2价(举两例),也可以判断氧、硫两种元素的非金属性强弱.
;其水溶液在空气中放置易变浑浊,写出反应的化学方程式2H2S+O2→2S↓+2H2O;该变化说明S的非金属性比O弱(填“强”或“弱”),从原子结构的角度解释原因:硫原子半径大于氧原子,硫原子的电子能力小于氧原子.通过H2O的稳定性大于H2S或SO2中硫是+4价,氧是-2价(举两例),也可以判断氧、硫两种元素的非金属性强弱.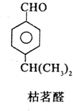 $→_{一定条件}^{试剂X}$A
$→_{一定条件}^{试剂X}$A B$→_{一定条件}^{2H_{2},Ni}$C$→_{△}^{Cu,O_{2}}$
B$→_{一定条件}^{2H_{2},Ni}$C$→_{△}^{Cu,O_{2}}$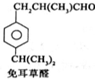
 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$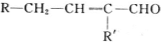
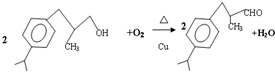 +H20.
+H20. 、
、 .
.