题目内容
3.部分中学化学常见元素原子结构及性质如表所示:| 序号 | 元素 | 结构及性质 |
| ① | A | A单质是生活中常见金属,它有两种常见氯化物,相对分子质量相差35.5 |
| ② | B | B原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| ③ | C | C是常见化肥的主要元素,单质常温下呈气态 |
| ④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| ⑤ | E | 通常情况下,E没有最高正化合价,A、B、C、D、F都能与E形成化合物 |
| ⑥ | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
(2)B与C形成的化合物的化学式为Mg3N2,写出电子式

(3)①C与F组成的5核阳离子的鉴别方法加入浓NaOH溶液加热,生成气体若能够使湿润的红色石蕊试纸变蓝,说明含有铵根离子
②C与F组成18电子化合物结构式为

(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱4NH3+3O2(纯)$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O
(5)工业制备D的粗产品的化学反应方程式为SiO2+2C═Si+2CO↑.
分析 A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5,说明其A具有变价,则A为Fe元素;B原子最外层电子数是内层电子总数的$\frac{1}{5}$,原子只能有3个电子层,最外层电子数为2,故B为Mg元素;C是常见化肥的主要元素,单质常温下呈气态,则C为N元素;D单质被誉为“信息革命的催化剂”,是常用的半导体材料,D为Si;F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族,则F为H元素;通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物,则E为O元素,据此解答.
解答 解:A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5,则A为Fe;B原子最外层电子数是内层电子总数的$\frac{1}{5}$,原子只能有3个电子层,最外层电子数为2,故B为Mg元素;C是常见化肥的主要元素,单质常温下呈气态,则C为N元素;D单质被誉为“信息革命的催化剂”,是常用的半导体材料,D为Si;F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族,则F为H元素;通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物,则E为O元素,
(1)A为Fe元素,在周期表中的位置为:第四周期Ⅷ族,
故答案为:第四周期Ⅷ族;
(2)B与C形成的化合物的化学式为Mg3N2,Mg3N2为离子化合物,其电子式为 ,
,
故答案为:Mg3N2; ;
;
(3))①C与F分别为N、H元素,二者组成的5核阳离子为铵根离子,能使湿润的红色石蕊试纸变蓝色的气体是氨气,先加入浓氢氧化钠溶液将铵根离子转化为氨气,然后再用湿润的红色石蕊试纸检验氨气,
故答案为:加入浓NaOH溶液加热,生成气体若能够使湿润的红色石蕊试纸变蓝,说明含有铵根离子;
②N、H组成18电子化合物为N2H4,是共价化合物,氮原子和氢原子形成共价键,氮原子和氮原子间也形成共价键,其结构式为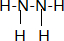 ,
,
故答案为: ;
;
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱:4NH3+3O2(纯)$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O,
故答案为:4NH3+3O2(纯)$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O;
(5)碳能与二氧化硅反应生成硅单质,工业制备Si的粗产品的化学反应方程式为:SiO2+2C═Si+2CO↑,
故答案为:SiO2+2C═Si+2CO↑.
点评 本题考查位置结构与性质关系的应用,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题有利于提高学生的分析、理解能力及逻辑推理能力.

 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为CH3COOH>H2CO3>HClO.
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为
CO32->ClO->HCO3->CH3COO-.
(3)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:ClO-+H2O+CO2=HClO+HCO3-.
(4)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,填写下列表达式中的数据变化情况(填“变大”、“变小”或“不变”)
①$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$变大; ②$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变.
(5)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数,理由是当完全电离时应该是PH=4,现在PH值HX>CH3COOH,说明原来HX电离更多,故HX的电离平衡常数>醋酸的电离平衡常数.

(1)制备碳酸镧实验流程中导管从左向右的连接顺序为:F→A→B→D→E→C
(2)Y中发生反应的化学反应式为NH3.H2O+CaO=Ca(OH)2+NH3↑
(3)X中盛放的试剂是NaHCO3溶液,其作用为吸收挥发的HCl、同时生成CO2
(4)Z中应先通入NH3,后通入过量的CO2,原因为NH3在水中溶解度大
(二)氢氧化铈[Ce(OH)4]是一种重要的稀土氢氧化物,它可由氟碳酸铈精矿(主要含CeFCO3)经如下流程获得:

已知:在酸性溶液中Ce4+有强氧化性,回答下列问题:
(5)氧化焙烧生成的铈化合物二氧化铈(CeO2),其在酸浸时反应的离子方程式为2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O.
(6)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:
2Ce3+(水层)+6HT(有机层)2CeT3(有机层)+6H+(水层)
从平衡角度解释:向CeT3(有机层)加入H2SO4获得较纯的含Ce3+的水溶液的原因是混合液中加硫酸导致氢离子浓度增大,平衡向生成Ce3+水溶液方向移动.
(7)已知298K时,Ksp[Ce(OH)3]=1×10-20,为了使溶液中Ce3+沉淀完全,需调节pH至少为9.
(8)取某Ce(OH)4产品0.50g,加硫酸溶解后,用0.1000mol•L-1的FeSO4溶液滴定至终点(铈被还原成Ce3+).
①FeSO4溶液盛放在酸式(填“酸式”或“碱式”)滴定管中.
②根据下表实验数据计算Ce(OH)4产品的纯度95.68%.
| 滴定次数 | FeSO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | |
| 第一次 | 0.50 | 23.60 |
| 第二次 | 1.00 | 26.30 |
| 第三次 | 1.20 | 24.10 |
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(2)写出A、B、C形成的化合物M的电子式
 ;B和C的离子中,半径较小的是Na+(填离子符号 );五种原子中半径最大的是Na(填元素符号 ).五种元素最高价氧化物的水化物酸性最强的是(以上填化学式)HClO4.
;B和C的离子中,半径较小的是Na+(填离子符号 );五种原子中半径最大的是Na(填元素符号 ).五种元素最高价氧化物的水化物酸性最强的是(以上填化学式)HClO4.(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键.
(4)D单质与M的水溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
| A. | 若可以水解,且能发生银镜反应,则其同分异构有8种 | |
| B. | 若可以与碳酸氢钠溶液反应生成CO2,则其同分异构有8种 | |
| C. | 一定能与Na反应生成H2 | |
| D. | 可能与NaOH溶液反应 |


