题目内容
5.元素相互化合时,原子间通过电子得失或共用电子对,以达到稳定的电子层结构.下列各物质中所有原子没有同时都满足最外层为8电子结构的是( )| A. | N2 | B. | CO2 | C. | CH4 | D. | NaCl |
分析 共价化合物中,元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构,H原子最外层一定不满足8电子结构;离子化合物中,根据形成的阴阳离子分析是否满足8电子稳定结构即可.
解答 解:A.N2中,N与N原子之间有3个共用电子对,则N原子的最外层电子为5+3=8,满足8电子稳定结构,故A不选;
B.CO2中O元素化合价为-2,O原子最外层电子数为6,所以2+6=8,O原子满足8电子结构,C元素化合价为+4,C原子最外层电子数为4,所以4+4=8,C原子满足8电子结构,故B不选;
C.甲烷分子中,H原子的最外层电子数为2,没有满足8电子稳定结构,故C选;
D.NaCl为离子化合物,钠离子和氯离子的最外层都满足8电子稳定结构,故D不选;
故选C.
点评 本题考查原子核外电子排布,题目难度不大,注意掌握判断是否满足8电子结构的方法,可利用化合价与最外层电子数来分析即可解答,注意掌握原子核外电子排布规律,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法正确的是( )
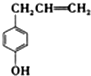

| A. | 该化合物属于芳香烃 | |
| B. | 1mol该化合物最多可与3molBr2发生反应 | |
| C. | 它的部分同分异构体能发生银镜反应 | |
| D. | 该化合物不能使酸性高锰酸钾溶液褪色 |
20.已知FeCl2溶液和KI溶液能发生如下反应:2FeCl3+2KI=2FeCl2+2KCl+I2,该反应属于( )
| A. | 化合反应 | B. | 置换反应 | C. | 复分解反应 | D. | 氧化还原反应 |
10.金刚石和石墨是碳元素的两种结构不同的单质.在100kPa时,1mol石墨转化为金刚石,要吸收1.9kJ的热能.下列说法不正确的是( )
| A. | 石墨比金刚石稳定 | |
| B. | 金刚石和石墨的物理性质相同 | |
| C. | 1mol金刚石比1mol石墨的总能量高 | |
| D. | 1mol金刚石完全燃烧释放的能量比1mol石墨完全燃烧释放的能量多 |
17.下列离子方程式书写错误的是( )
| A. | 石灰石溶于稀盐酸:CaCO3+2H+═CO2↑+Ca2++H2O | |
| B. | 钠与冷水反应:Na+2H2O═Na++OH-+H2↑ | |
| C. | 铁与稀盐酸反应:Fe+2H+═H2↑+Fe2+ | |
| D. | 铝粉与氢氧化钠溶液反应:2Al+2H2O+2OH-═2AlO2-+3H2↑ |
14.下列物质能与金属钠、碳酸氢钠溶液、碳酸钠溶液都能反应的是( )
| A. | 苯酚 | B. | 苯甲酸 | C. | 苯甲醛 | D. | 乙二醇 |
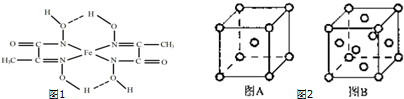
 ;
; 已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增.B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3P轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体.根据以上信息,回答下列问题:
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增.B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3P轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体.根据以上信息,回答下列问题: