题目内容
已知N2中1molN≡N键完全断裂时吸收热量945.6kJ,氨气中形成1molH-N键时放出热量391kJ,根据热化学方程式:N2(g)+3H2(g)?2NH3(g),△H=-92.4kJ?mol-1,则H2中1molH-H键断裂时吸收热量是( )
| A、45kJ |
| B、436kJ |
| C、1308kJ |
| D、135kJ |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:在化学反应中,旧键断裂吸收的能量和新键生成释放的能量之差即为反应的能量变化值,当旧键断裂吸收的能量大于新键生成释放的能量时,反应表现为吸热,当旧键断裂吸收的能量小于新键生成释放的能量时,反应表现为放热.
解答:
解:假设H-H键键能为x,根据在化学反应中,旧键断裂吸收的能量和新键生成释放的能量之差即为反应的能量变化值,
当旧键断裂吸收的能量小于新键生成释放的能量时,反应表现为放热,可以得到:945.6KJ/mol+3x-391kJ/mol×6=-92.4kJ/mol,
解得x=436KJ/mol.
故选B.
当旧键断裂吸收的能量小于新键生成释放的能量时,反应表现为放热,可以得到:945.6KJ/mol+3x-391kJ/mol×6=-92.4kJ/mol,
解得x=436KJ/mol.
故选B.
点评:本题考查学生化学反应能量变化的知识,旧键断裂吸收的能量和新键生成释放的能量之差即为反应的能量变化值是解题的关键.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
 一定条件下,将一定量的A、B、C、D四种物质,置于密闭容器中发生如下反应:mA(s)+nB(g)?pC(g)+q(D)g.达到平衡后,测得B的浓度为0.5mol/L.保持温度不变,将密闭容器的容积扩大到原来的两倍,再次达到平衡后,测得B的浓度为0.2mol/L.当其条件不变时,C在反应混合物中的体积分数(x)与温度(T)、时间(t)的关系如图所示,下列叙述正确的是( )
一定条件下,将一定量的A、B、C、D四种物质,置于密闭容器中发生如下反应:mA(s)+nB(g)?pC(g)+q(D)g.达到平衡后,测得B的浓度为0.5mol/L.保持温度不变,将密闭容器的容积扩大到原来的两倍,再次达到平衡后,测得B的浓度为0.2mol/L.当其条件不变时,C在反应混合物中的体积分数(x)与温度(T)、时间(t)的关系如图所示,下列叙述正确的是( )| A、容积扩大到原来的两倍,平衡向逆反应方向移动 |
| B、化学方程式中n>p+q |
| C、达到平衡后,若升高温度,平衡向逆反应方向移动 |
| D、达到平衡后,增加A的量,有利于提高B的转化率 |
下列实验操作中不正确的是( )
| A、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口附近 |
| B、蒸发操作时,应使混合物的水分完全蒸干后才能停止加热 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、萃取操作时,应选择有机萃取剂,它与原溶剂应互不相溶 |
普罗帕酮为广谱高效抗心律失常药.下列说法正确的是( )


| A、反应物X与中间体Y互为同分异构体 |
| B、用一个氯原子取代X苯环上氢,产物只有3种 |
| C、普罗帕酮分子中有2个手性碳原子 |
| D、X、Y和普罗帕酮都能发生加成、水解、氧化、消去反应 |
如图示装置是化学实验室的常用装置,它有多种用途.以下各项用途的操作都正确的是( )
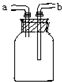

| A、洗气或干燥装置:瓶内放一定体积溶液,由a进气 |
| B、用于收集不溶于水的气体:瓶内充满水,由a进气 |
| C、提供少量CO:瓶内充满CO,a接自来水龙头 |
| D、病人输氧时用于观察输氧速度:瓶内装适量水,b接病人鼻腔 |
有关甲、乙、丙、丁四个图示的叙述正确的是( )


| A、甲中负极反应式为2H++2e-═H2↑ |
| B、乙中阳极反应式为Ag++e-═Ag |
| C、丙中H+向碳棒方向移动 |
| D、丁中电解开始时阳极产生黄绿色气体 |
下列实验操作中正确的是( )
| A、用规格为100 mL筒量取4 mL的液体 |
| B、把粉末状药品直接送入试管的底部 |
| C、过滤时玻璃棒要靠在三层的滤纸上 |
| D、如果没有试管夹,可以临时手持试管给固体或液体加热 |


 ):
):
 原子序数依次增大的X、Y、Z、M、N五种元素,XZ2是引起温室效应的主要气体,M
原子序数依次增大的X、Y、Z、M、N五种元素,XZ2是引起温室效应的主要气体,M